黄荷凤院士领衔!揭示代谢异常与表观遗传交叉调控多囊卵巢综合征新机制,PKM2介导的组蛋白乳酸化或是关键致病因素
| 导读 | 该研究不仅阐明了代谢异常与表观遗传交叉调控PCOS的新机制,更通过小分子抑制剂成功逆转小鼠模型症状,为PCOS的精准治疗开辟了新路径。 |
多囊卵巢综合征(PCOS)作为育龄女性最常见的内分泌代谢疾病,其病因不明、治疗手段有限,长期困扰临床医学。11月19日,复旦大学附属妇产科医院黄荷凤/杨红波/刘欣梅团队在《信号转导与靶向治疗》(Signal Transduction and Targeted Therapy,IF=52.7)发表最新研究:首次揭示PKM2(丙酮酸激酶M2)通过核易位促进组蛋白乳酸化修饰,重构三维基因组结构,从而激活PCOS关键致病基因的表达。该研究不仅阐明了代谢异常与表观遗传交叉调控PCOS的新机制,更通过小分子抑制剂成功逆转小鼠模型症状,为PCOS的精准治疗开辟了新路径。
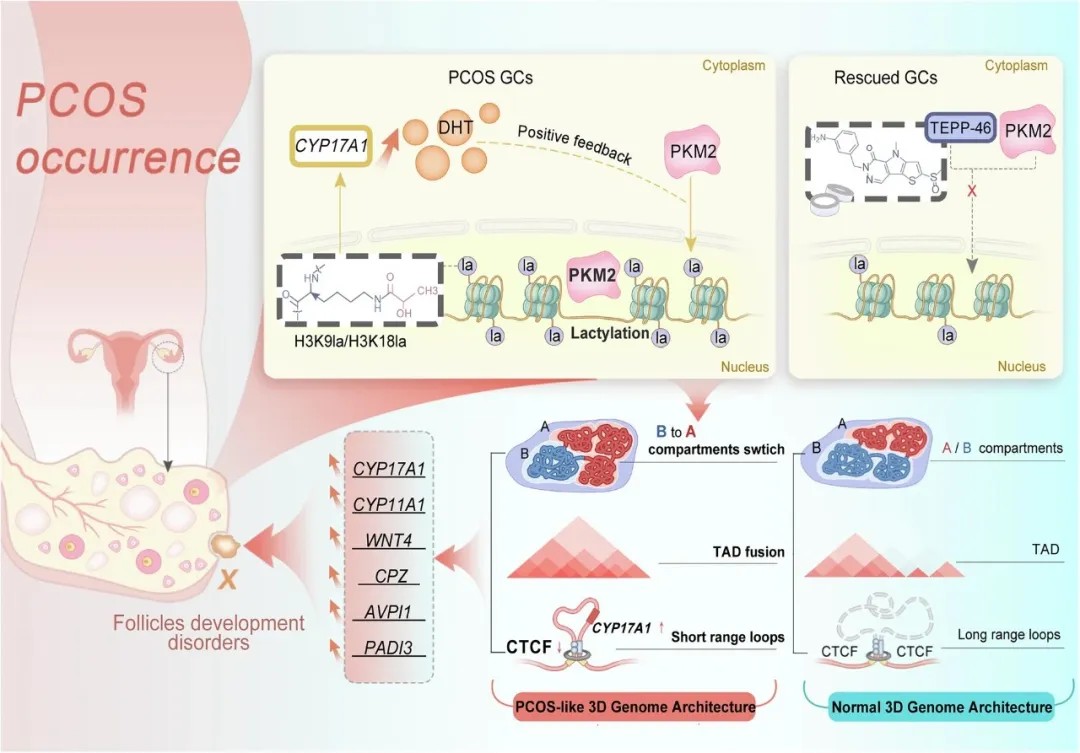
提出PKM2/组蛋白乳酸化模块促进PCOS发生的理论模型
研究背景:PCOS的代谢异常
PCOS以高雄激素血症、排卵障碍和卵巢多囊样改变为特征,常伴随肥胖、胰岛素抵抗等代谢问题。既往研究提示,PCOS患者卵巢局部存在糖酵解异常,例如颗粒细胞中糖酵解关键酶表达失调,但代谢紊乱如何直接导致基因表达异常尚不明确。
核心发现一:PKM2核易位驱动组蛋白乳酸化
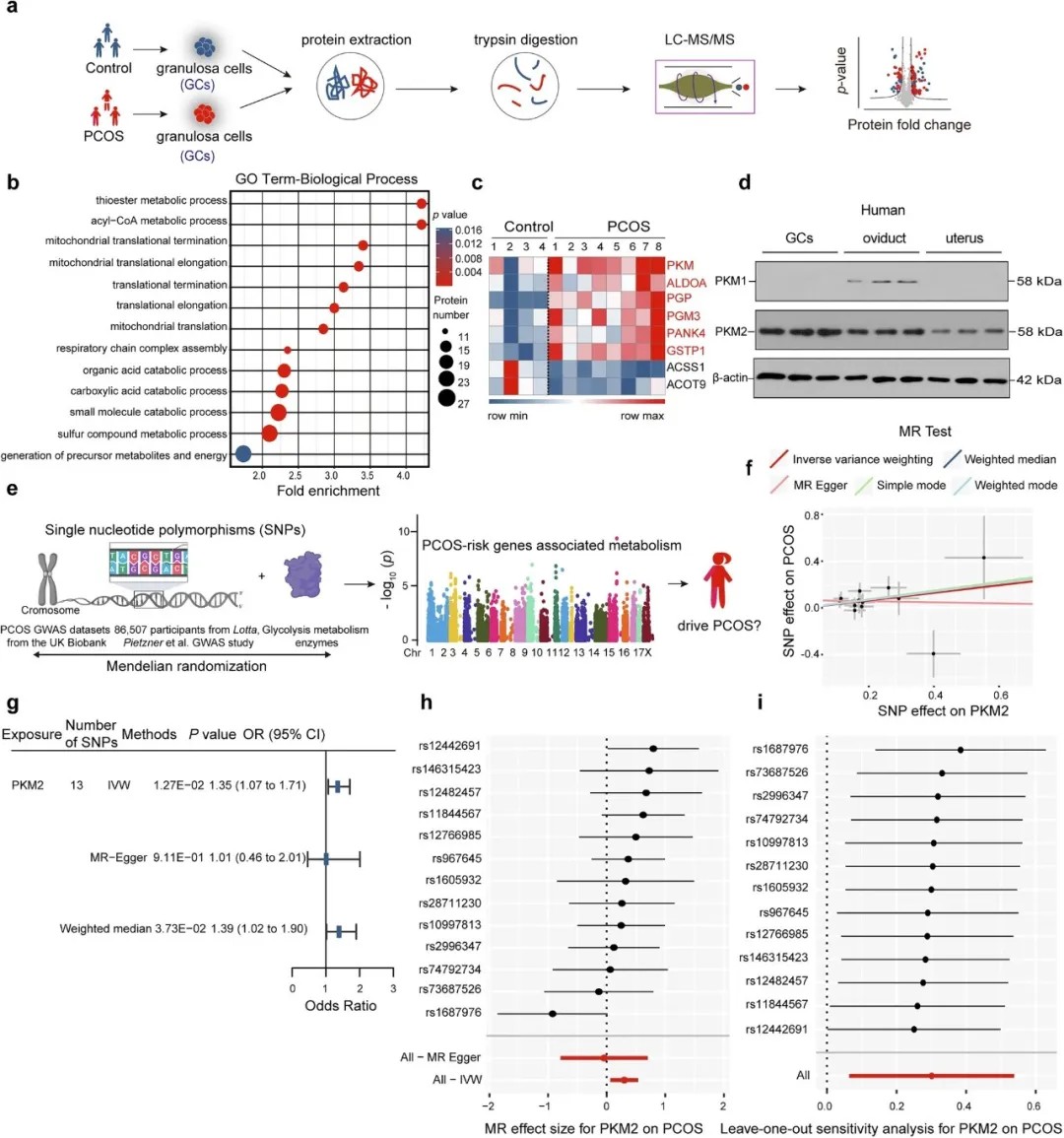
PCOS患者黄素化颗粒细胞的蛋白质组学分析及孟德尔随机化分析揭示PKM2与PCOS的关联
研究通过孟德尔随机化分析和临床样本蛋白质组学筛查,发现PKM2在PCOS患者颗粒细胞中显著上调,且其核易位与高雄激素水平密切相关。
研究团队发现,PCOS患者颗粒细胞中PKM2易位至细胞核,通过ERK信号通路被雄激素激活。核内PKM2催化乳酸生成,显著提升组蛋白H3K9、H3K18和H3K27的乳酸化修饰水平。这种修饰作为一种新型表观遗传标记,直接改变染色质活性状态。
通过多组学分析,研究者证实PKM2结合位点与H3K9la、H3K18la修饰区域高度重叠,且富集于CYP17A1、CYP11A1等PCOS相关基因的调控区域。
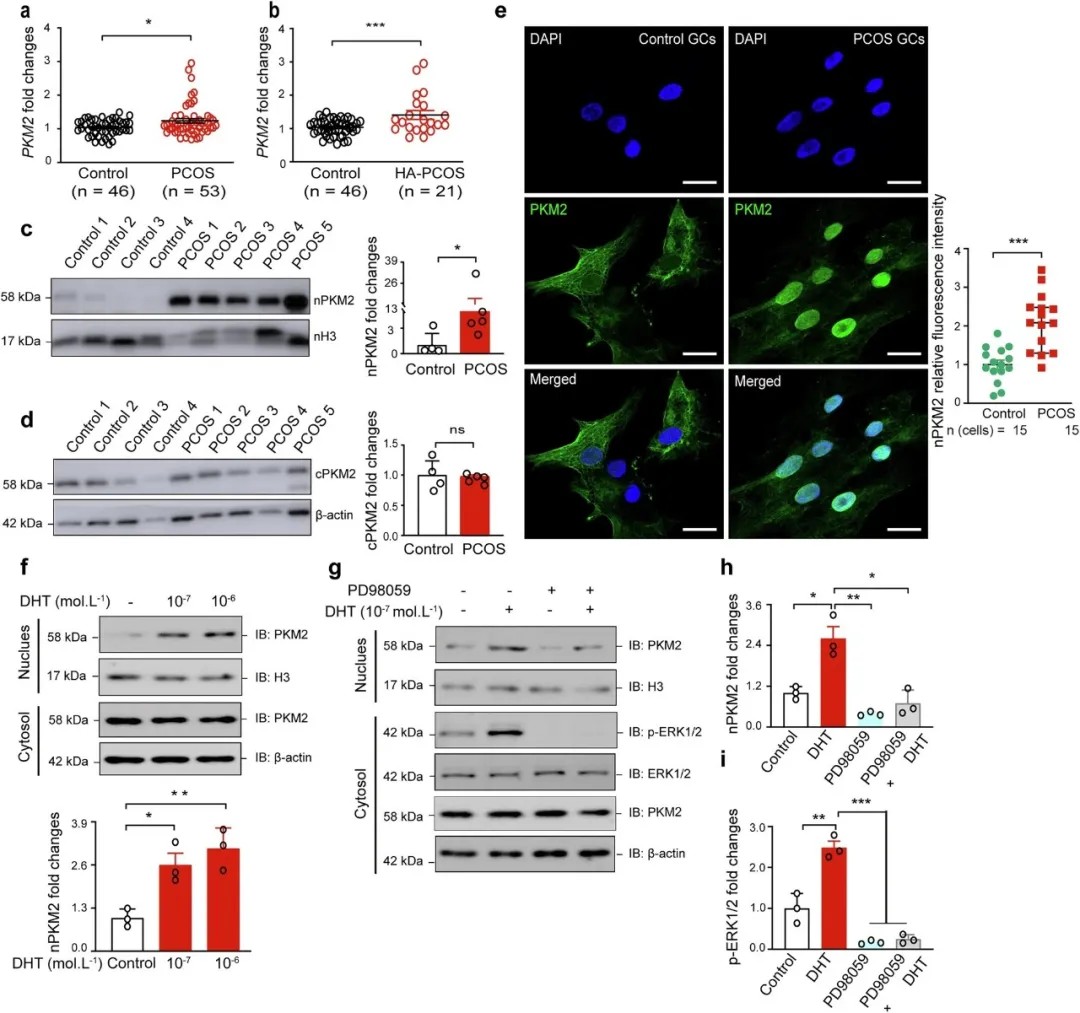
PKM2在PCOS患者颗粒细胞核中积累
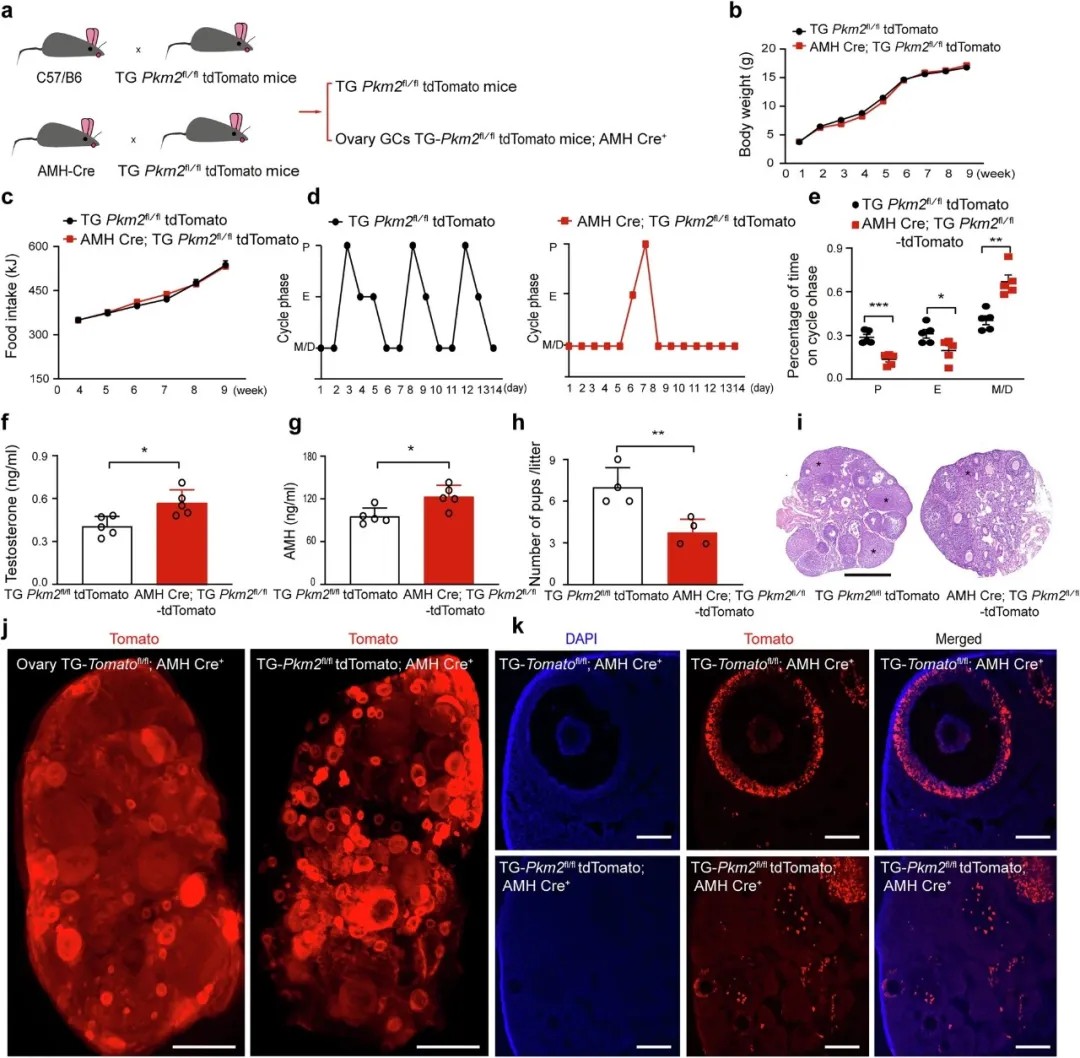
颗粒细胞Pkm2诱导线粒体功能障碍并促进PCOS样生殖功能障碍
核心发现二:三维基因组重构激活致病基因
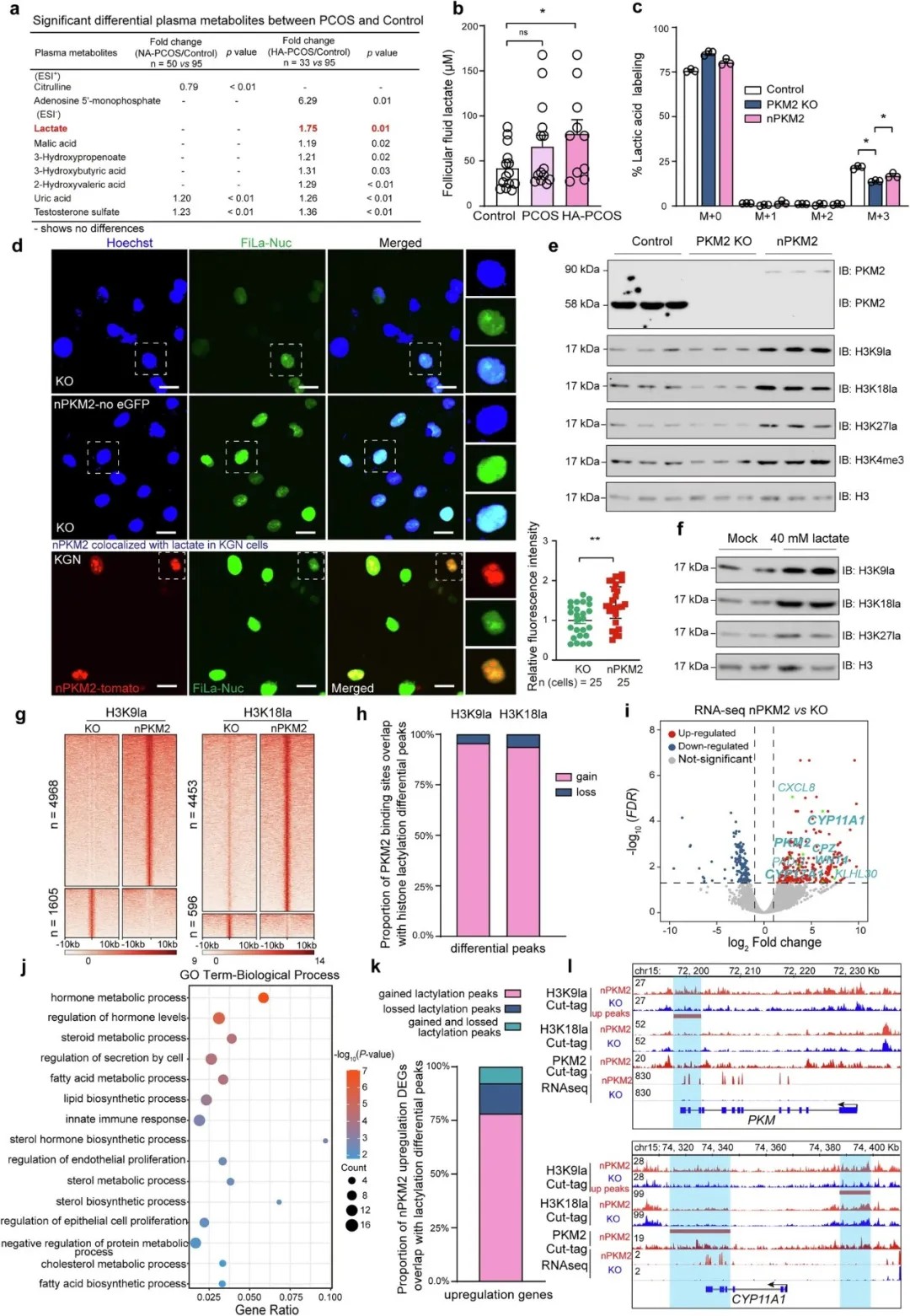
核PKM2诱导全局组蛋白乳酸化并上调PCOS相关基因
进一步的高通量染色质构象捕获(Hi-C)分析显示,组蛋白乳酸化修饰可引发三维基因组结构的全局性重构:
-
染色质区室转换:7.05%的基因组区域由静止状态向活跃状态转换,促进基因转录;
-
TAD边界弱化:PKM2结合导致CTCF蛋白结合减少,拓扑相关结构域(TAD)融合,使远端增强子与启动子相互作用;
-
新型染色质环形成:CYP17A1等基因启动子与410 kb外的调控元件形成新环路,表达量提升49倍。
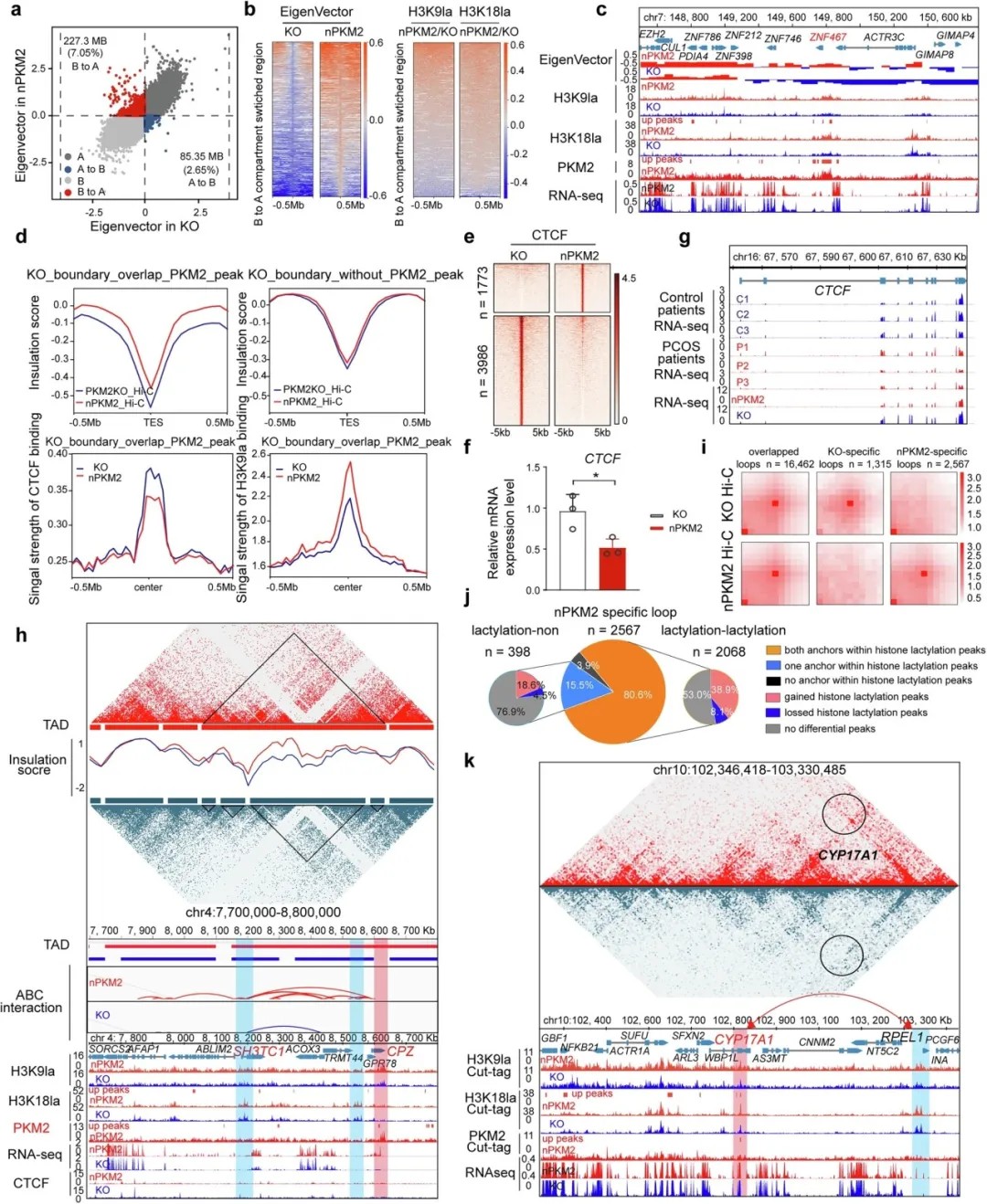
核PKM2诱导的组蛋白乳酸化驱动KGN细胞中三维基因组结构的改变
动物模型验证治疗潜力
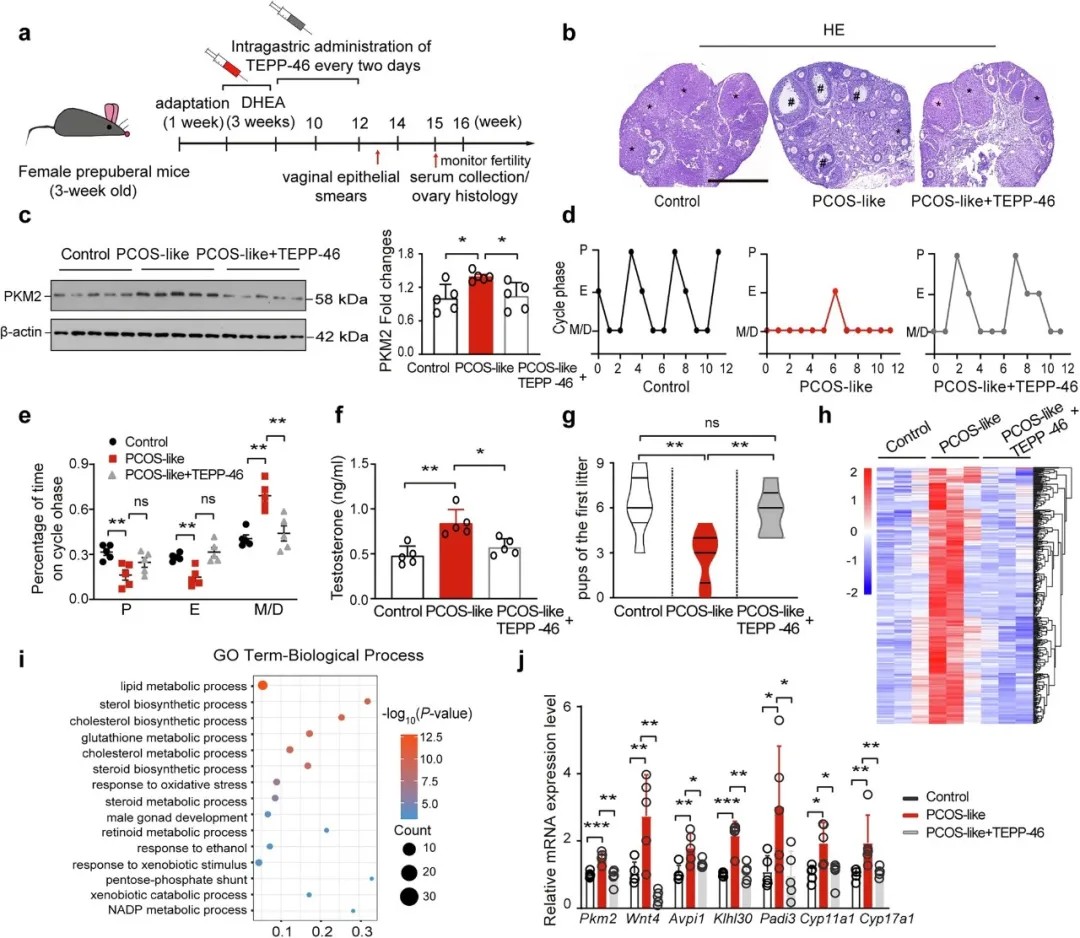
TEPP-46可逆转PCOS样小鼠表型及相关基因的上调
研究团队构建了颗粒细胞特异性过表达Pkm2的转基因小鼠,成功模拟PCOS表型(动情周期紊乱、高雄激素、卵巢多囊样变)。通过小分子化合物TEPP-46抑制PKM2核易位,不仅逆转了小鼠的激素异常和排卵障碍,还使卵巢转录组谱恢复至野生型水平。值得注意的是,TEPP-46可促进PKM2形成胞质四聚体,阻断其核转移,且对体重无显著影响,提示其治疗潜力。
研究意义与临床应用
该研究首次提出“雄激素-PKM2-组蛋白乳酸化”正反馈环路是PCOS的核心发病机制之一,突破了传统代谢干预的局限。靶向PKM2核易位有望成为PCOS的病因学治疗策略,尤其适用于高雄激素型患者。
原文链接:
https://www.nature.com/articles/s41392-025-02468-5(转化医学网360zhyx.com)
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
责任声明:本稿件如有错误之处,敬请联系转化医学网客服进行修改事宜!
微信号:zhuanhuayixue
 腾讯登录
腾讯登录






还没有人评论,赶快抢个沙发