Genome Medicine | 马国林/舒妮团队揭示阿尔茨海默病多基因风险如何提前驱动大脑退化
| 导读 | 这项研究让我们首次看清,AD风险是如何随着年龄一步步啃食大脑的。未来,需结合遗传、环境和生活方式,为高风险人群打造个性化防护网。
|
对于全球超5500万阿尔茨海默病(AD)患者而言,疾病何时开始侵蚀大脑始终是未解的谜题。近日,中日友好医院马国林&北京师范大学舒妮团队一项发表于国际权威期刊《Genome Medicine》的最新研究揭示了阿尔茨海默病多基因风险评分(AD-PRS)在健康老龄化过程中的动态影响。通过对英国生物银行(UK Biobank)中21,236名无认知障碍的老年人进行分析,研究团队发现:高AD-PRS与脑结构加速退化和认知功能下降显著相关,且这些效应随年龄增长而增强,并验证了APOE基因在此过程中的主导作用。

AD-PRS对区域脑体积指标的年龄相关性影响
研究背景
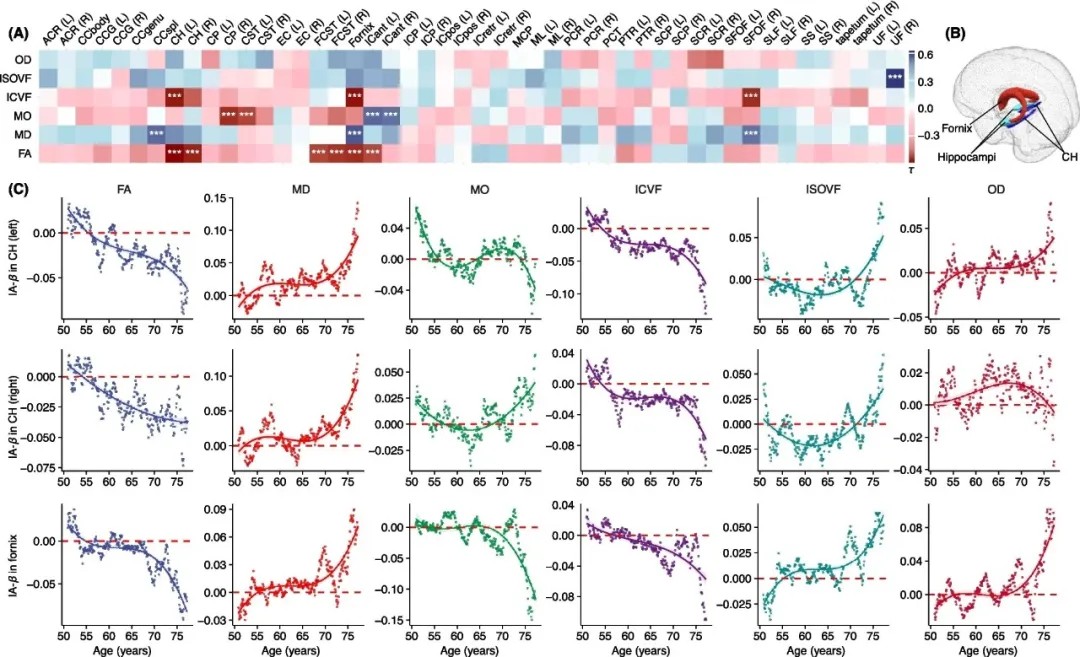
AD-PRS对白质纤维束微结构完整性的年龄相关性影响
AD是一种由多基因和环境共同驱动的神经退行性疾病,其早期病理改变(如淀粉样蛋白沉积、脑萎缩)可早于症状出现数十年。全基因组关联研究(GWAS)已识别出数千个AD相关基因位点,而AD多基因风险评分(AD-PRS)作为整合这些位点风险的工具,能更全面地评估个体患病风险。此前研究发现,高AD-PRS与AD病理负荷、脑萎缩相关,但这些风险如何在无症状期随年龄动态演变,以及结构变化是否直接介导认知下降,仍是未填补的空白。
研究设计与核心发现
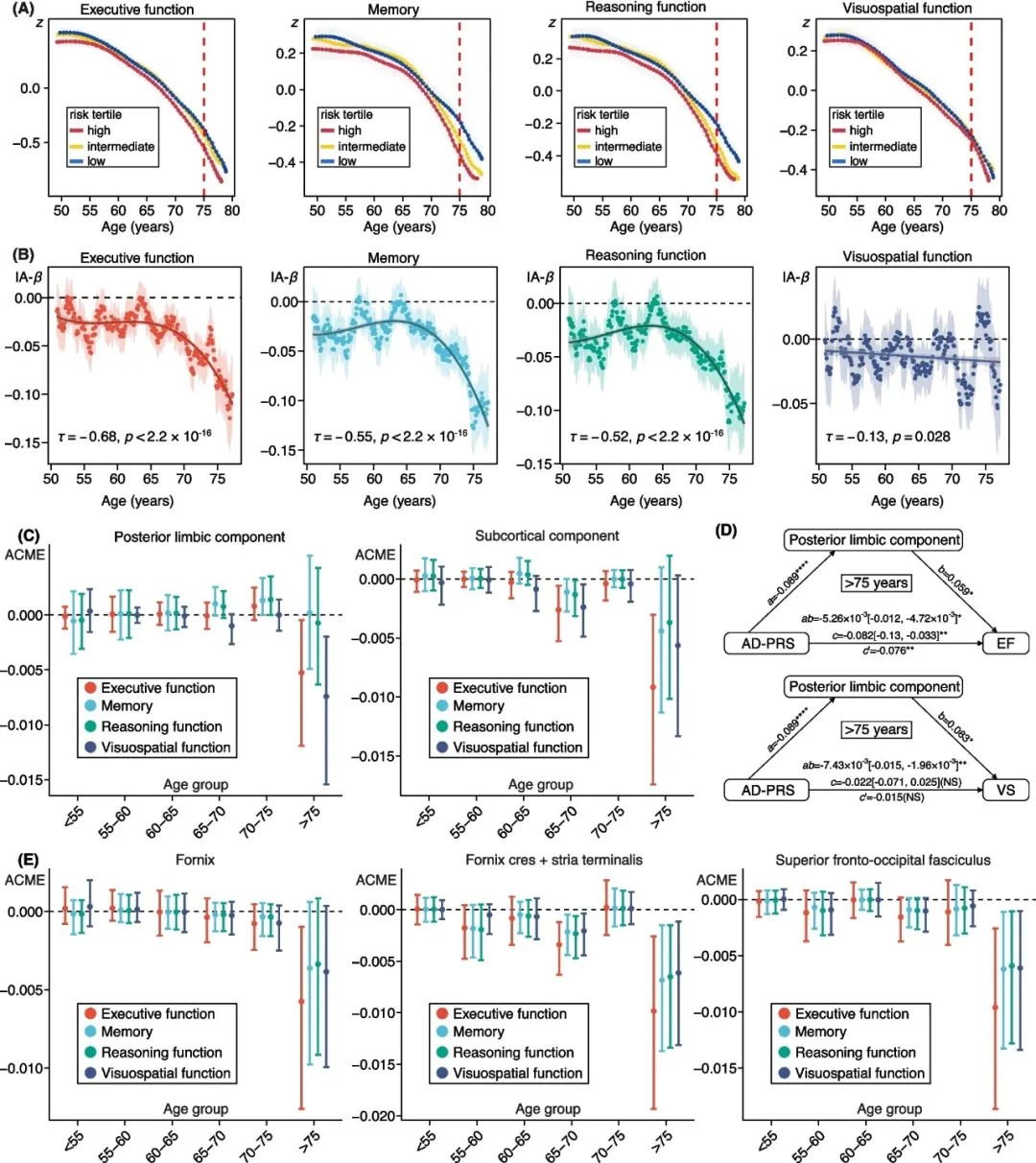
AD-PRS、影像学生物标志物与认知功能的年龄相关性
研究采用多模态神经影像数据和遗传分析,结合滑动窗口分析和中介模型,系统评估了AD-PRS对脑灰质体积、白质微结构及认知功能的年龄依赖性影响。研究还通过敏感性分析验证了APOE基因的主导作用,并首次揭示了非APOE遗传变异的年龄特异性贡献。
主要核心发现:
-
脑结构加速退化:高AD-PRS个体表现出灰质体积的快速减少,尤其在海马体、丘脑和旁海马区,脑室体积亦显著扩大。白质微结构完整性(如穹窿、扣带束和上额枕束)的下降同样与高风险相关。
-
年龄放大效应:多基因风险对脑结构的影响从50岁中期开始显现,70岁后效应强度显著增加。例如,海马体体积的下降效应在55岁左右启动,75岁时标准化效应值达到-0.09。
-
认知功能的中介机制:执行功能、记忆和推理能力下降与AD-PRS显著相关,且这些关联主要由后边缘系统(如海马体)及其白质连接的结构变化介导。
-
APOE与非APOE的协同作用:APOE ε4等位基因是主要风险驱动因素,但非APOE变异在70-75岁年龄组中显示出独立效应,表明白质完整性可能受到多基因网络的共同调控。
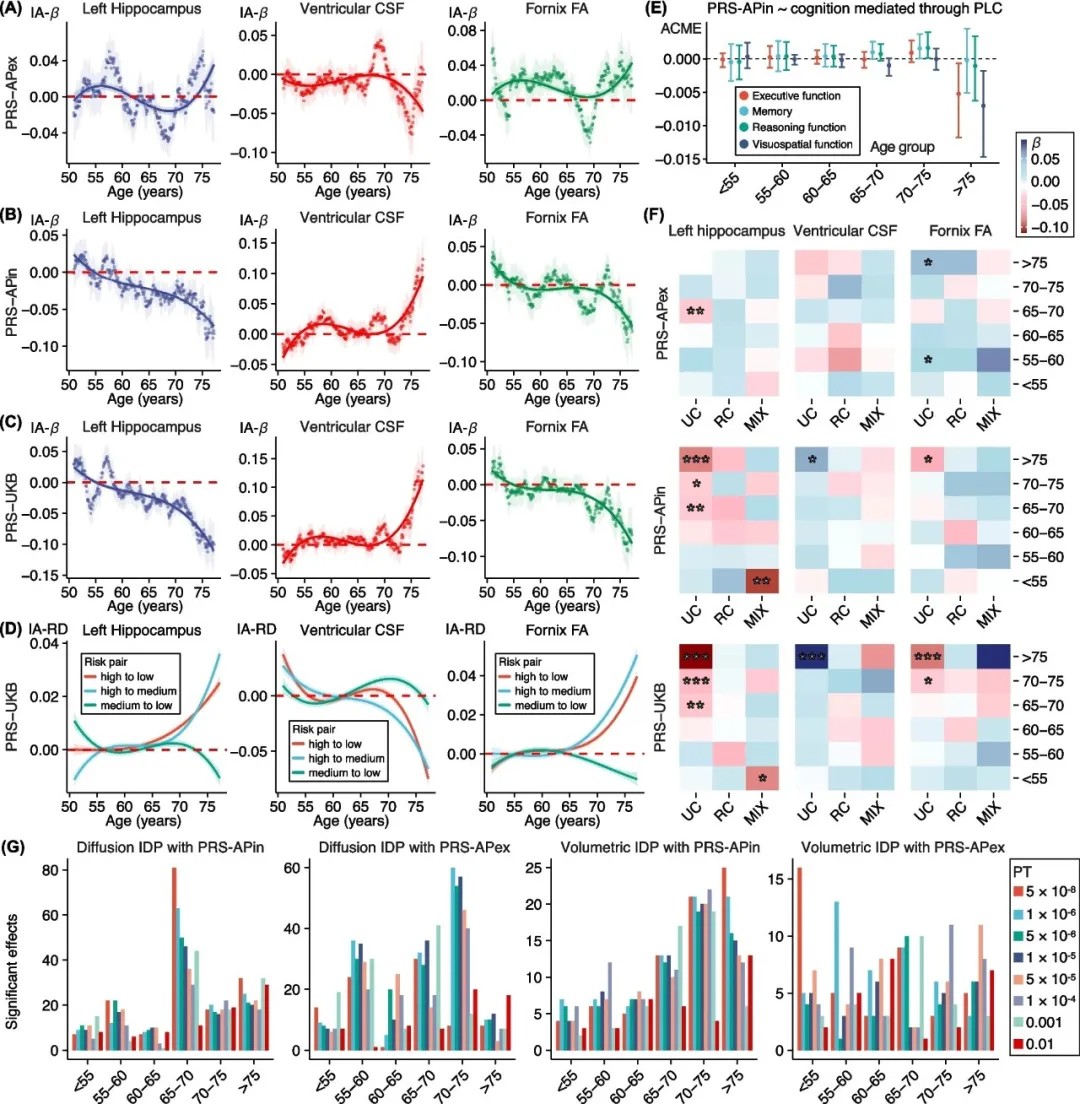
敏感性分析
研究意义与展望
这项研究的价值在于将AD的遗传风险转化为可追踪的脑结构变化,为无症状期的精准筛查提供了依据:对于高AD-PRS者,50岁起就需加强脑结构监测(如定期MRI),重点关注海马、丘脑及穹窿等区域;干预策略可针对结构损伤的上游——比如通过生活方式调整(运动、认知训练)延缓灰质萎缩,或用药物靶向白质损伤。这项研究让我们首次看清,AD风险是如何随着年龄一步步啃食大脑的。未来,需结合遗传、环境和生活方式,为高风险人群打造个性化防护网。(转化医学网360zhyx.com)
原文链接:
https://genomemedicine.biomedcentral.com/articles/10.1186/s13073-025-01548-z
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
责任声明:本稿件如有错误之处,敬请联系转化医学网客服进行修改事宜!
微信号:zhuanhuayixue
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发