靶向LTO1/YAE1可重启MHC-I表达,使“冷肿瘤”变“热”
| 导读 | 研究团队已提交专利,邀请制药企业洽谈授权或联合开发,以推动从实验室到临床的转化。 |
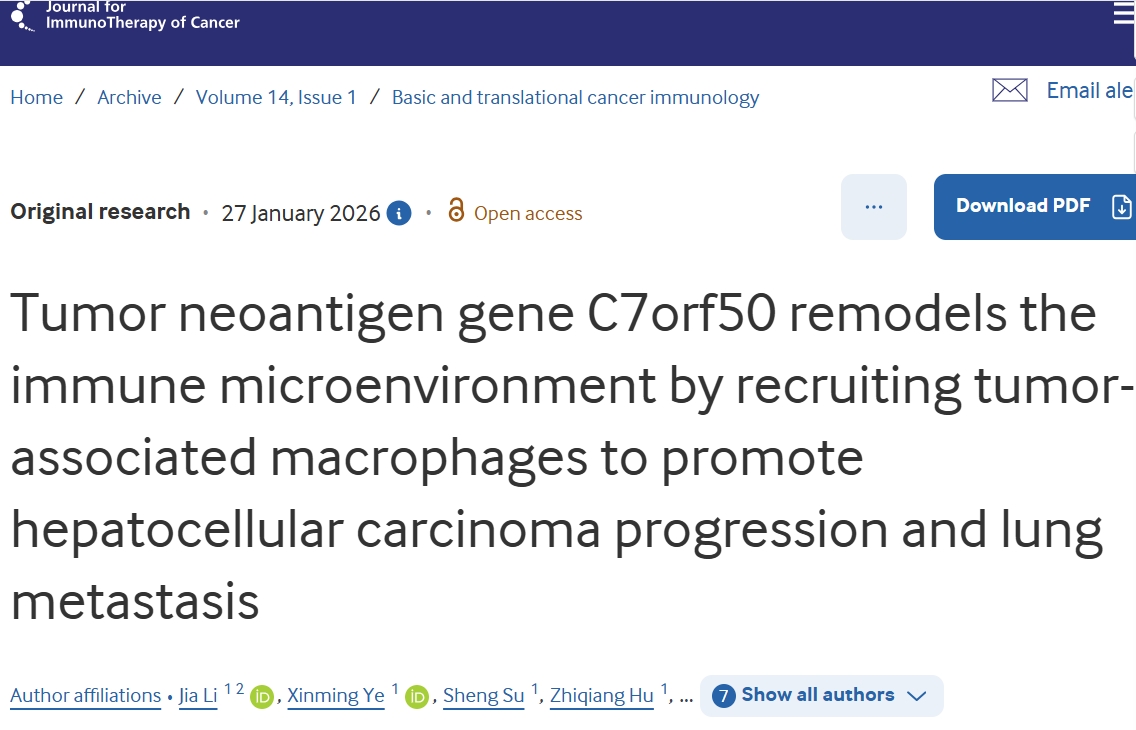
近日,广州医科大学王晓玲教授/冷启彬教授/邱力博士联合在《Journal for ImmunoTherapy of Cancer》上发表了一篇题为《LTO1 and YAE1 Regulate MHC-I expression via Nonsense-Mediated RNA Decay in Tumor Cells》的突破性研究,为增强肿瘤免疫治疗疗效提供了新机制和新方法。研究发现,LTO1和YAE1蛋白复合物通过调控无义介导的RNA衰减(NMD)途径,下调肿瘤细胞的主要组织相容性复合体I类(MHC-I)表达。该机制有助于肿瘤细胞逃避免疫监视。该研究进一步证实,低剂量铁螯合剂可抑制NMD功能,上调MHC-I表达,并提升免疫检查点阻断(ICB)和T细胞受体(TCR-T)疗法的效果。
研究背景
无义介导的mRNA降解(NMD)是一种翻译依赖性的监视系统,通过调控mRNA的质量和翻译水平,在发育、分化及应激等过程中维持细胞稳态。最初,NMD被发现可降解含有提前终止密码子(PTC)的mRNA,近年来研究表明,它也能调控正常转录本,从而在转录后水平广泛影响基因表达。NMD异常会导致多个物种中5%–20%的基因表达失调,并与多种人类遗传病及癌症的病理机制相关。
在肿瘤发生中,NMD具有双重作用:一方面可抑制肿瘤生长,清除编码应激反应蛋白和信号因子的正常mRNA;另一方面,NMD也可通过降解编码免疫原性新抗原的mRNA、优先靶向抑癌基因突变等方式促进肿瘤进展。因此,抑制NMD被认为可能有助于肿瘤免疫治疗,例如增强新抗原表达及恢复抑癌基因功能。
LTO1(ORAOV1)在多种实体瘤中高表达,位于肿瘤中频繁扩增的染色体区域11q13,其下调可抑制肿瘤细胞活力。LTO1与YAE1通过保守的deca-GX3基序结合,参与胞质Fe-S蛋白组装,并在酵母中调控核糖体成熟及翻译起始。值得注意的是,LTO1/YAE1的下游靶标ABCE1是已知的NMD调控因子,提示LTO1/YAE1可能通过ABCE1参与NMD过程。
核心机制研究
研究采用CRISPR/Cas9基因编辑技术,在多种肿瘤细胞系(如A375黑色素瘤和MC38结肠癌模型)中敲除LTO1、YAE1或相关因子ABCE1。结果显示,这些蛋白的缺失破坏了NMD功能,导致MHC-I调控因子(如NLRC5、IRF1和NFκB)的mRNA积累,并上调MHC-I表面表达数倍。通过荧光报告基因实验、流式细胞术(FACS)和RNA测序(RNA-seq),确认敲除后共有720个基因上调,其中包括NMD靶基因(如ATF3、GADD45A)。此外,LTO1/YAE1缺失还降低核糖体生物合成相关基因表达(如RPL7、RPL14),并改变核糖体亚基比例。
LTO1/YAE1复合物不仅参与核糖体生物合成,还通过铁硫簇组装途径调控翻译终止。研究发现,LTO1的deca-GX3基序突变体(如G38/42/46)可模拟敲除效果,表明该基序为潜在药物靶点。
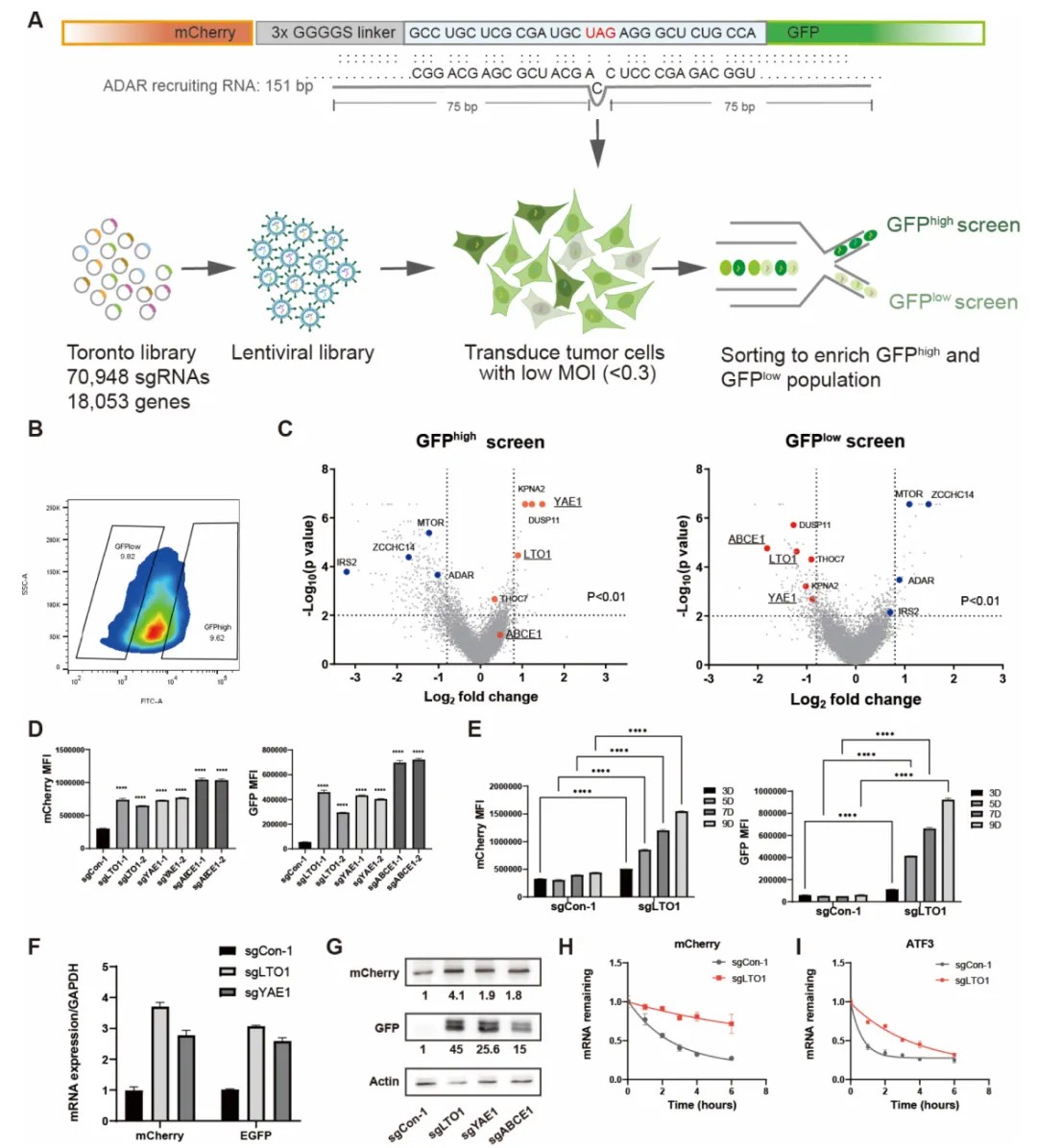
免疫调控验证
在体外T细胞共培养实验中,敲除这些靶点后,CD8+ T细胞激活率增加,肿瘤杀伤效率提高约30%。在小鼠模型中,与抗PD-1抗体联合使用,进一步抑制肿瘤生长,并增加肿瘤浸润淋巴细胞(TILs)数量。
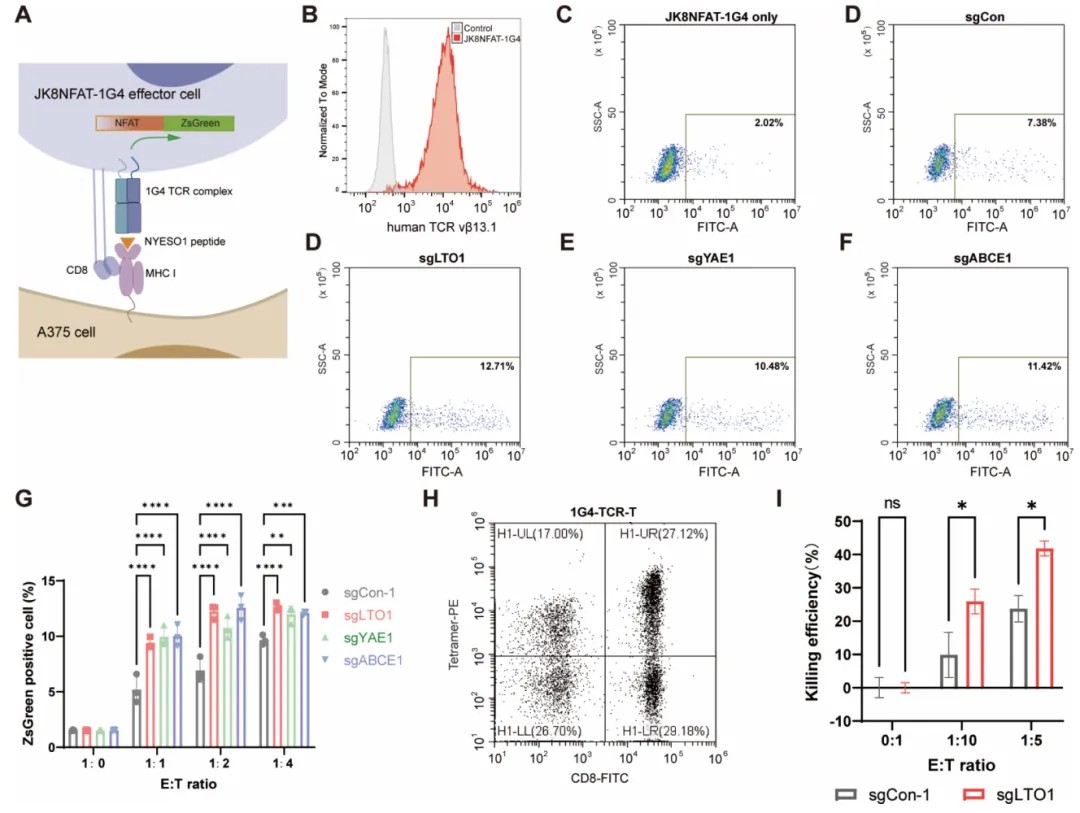
老药新靶探索
在药物干预方面,研究筛选出低剂量铁螯合剂(如去铁胺DFO和去铁酮DFX,已获FDA批准用于铁过载治疗)作为NMD抑制剂。在5-30µM浓度下,这些药物特异性阻断LTO1/YAE1介导的NMD,上调MHC-I表达。在跨物种细胞系验证中,低剂量DFO增强OT-I T细胞对MC38肿瘤的识别和杀伤。在体内实验中,与ICB联用后,肿瘤体积缩小幅度为单药治疗的2-3倍,OVA特异性TILs浸润增加。
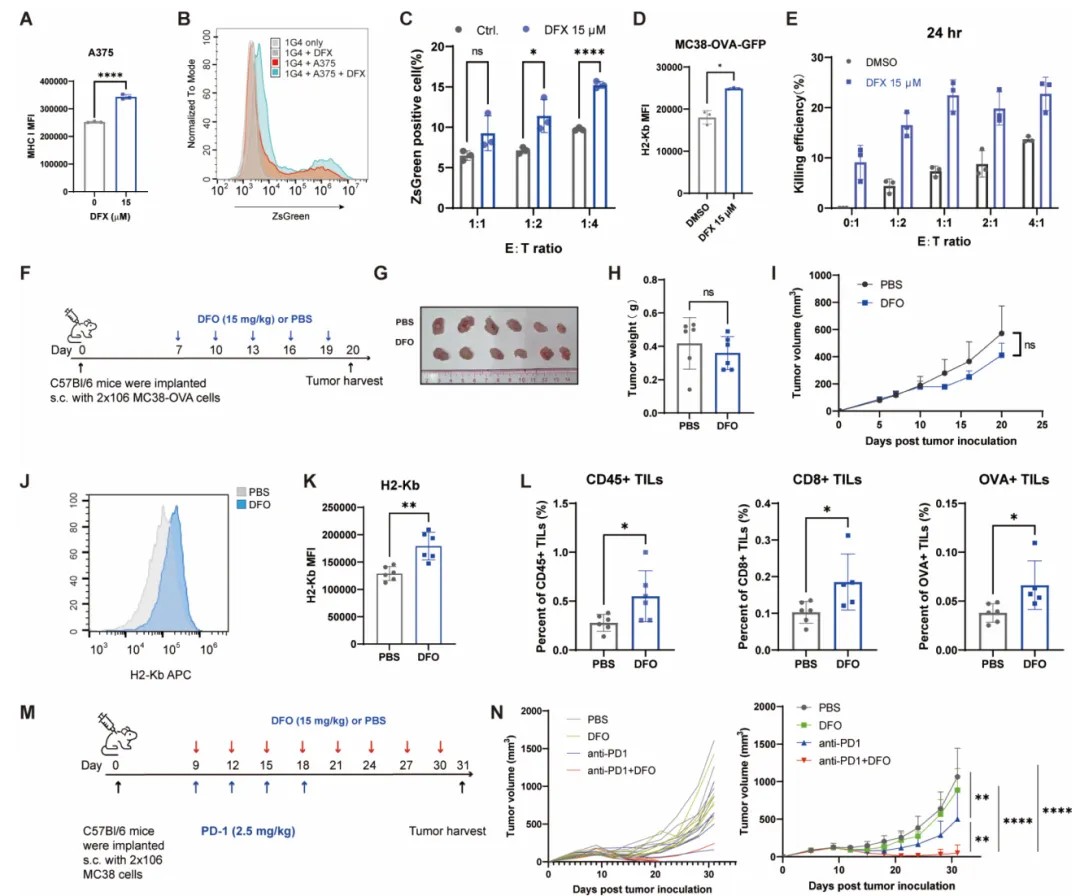
研究结论
研究显示:LTO1/YAE1复合物通过NMD调控MHC-I表达,其抑制可提升T细胞活性并改善免疫疗法效果。该研究为MHC-I低表达肿瘤提供了干预策略。LTO1/YAE1高表达可作为生物标志物,用于患者筛选。低剂量铁螯合剂的再利用可缩短临床转化周期。同时,针对LTO1/YAE1的原创小分子或抗体药物,或可与现有ICB/TCR-T产品(如Keytruda)形成联合方案,扩展免疫疗法应用。
研究团队已提交专利,邀请制药企业洽谈授权或联合开发,以推动从实验室到临床的转化。(转化医学网360zhyx.com)
原文链接:
https://jitc.bmj.com/lookup/doi/10.1136/jitc-2025-011893
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
责任声明:本稿件如有错误之处,敬请联系转化医学网客服进行修改事宜!
微信号:zhuanhuayixue
 腾讯登录
腾讯登录






还没有人评论,赶快抢个沙发