胃癌治疗新思路!中山大学肿瘤防治中心徐瑞华/鞠怀强团队首次揭示TGF-β抑制肿瘤生长的分子机制,提出双重靶向治疗新策略
| 导读 | 研究首次揭示了TGF-β通过调节代谢酶DLD的活性来抑制肿瘤生长的分子机制,并提出了将TGF-β抑制剂与代谢调节剂联合使用的双重靶向治疗新策略。 |
近日,中山大学肿瘤防治中心徐瑞华/鞠怀强团队在国际顶级学术期刊《Nature Communications》发表了一项关于胃癌TGF-β靶向治疗的重要研究。研究发现:虽然靶向TGF-β通路是胃癌治疗的潜在策略,但单纯抑制该通路可能意外释放肿瘤生长的“刹车”,盲目阻断可能适得其反,导致治疗效果不佳。研究首次揭示了TGF-β通过调节代谢酶DLD的活性来抑制肿瘤生长的分子机制,并提出了将TGF-β抑制剂与代谢调节剂联合使用的双重靶向治疗新策略。

抑制TGF-β信号未能改善胃癌模型的治疗效果
研究背景:TGF-β靶向治疗的悖论
转化生长因子-β(TGF-β)信号通路是细胞增殖、分化和凋亡的关键调节者,在肿瘤发生发展中扮演着复杂角色。在正常细胞和早期肿瘤中,TGF-β起抑制细胞增殖的作用;而在晚期肿瘤中,它却促进肿瘤进展和转移。
这种双重功能使得靶向TGF-β治疗陷入两难。理论上看,阻断TGF-β信号应能抑制肿瘤进展,但临床实践表明,针对TGF-β的单一疗法效果普遍不佳。
研究设计:发现单纯阻断TGF-β信号无效
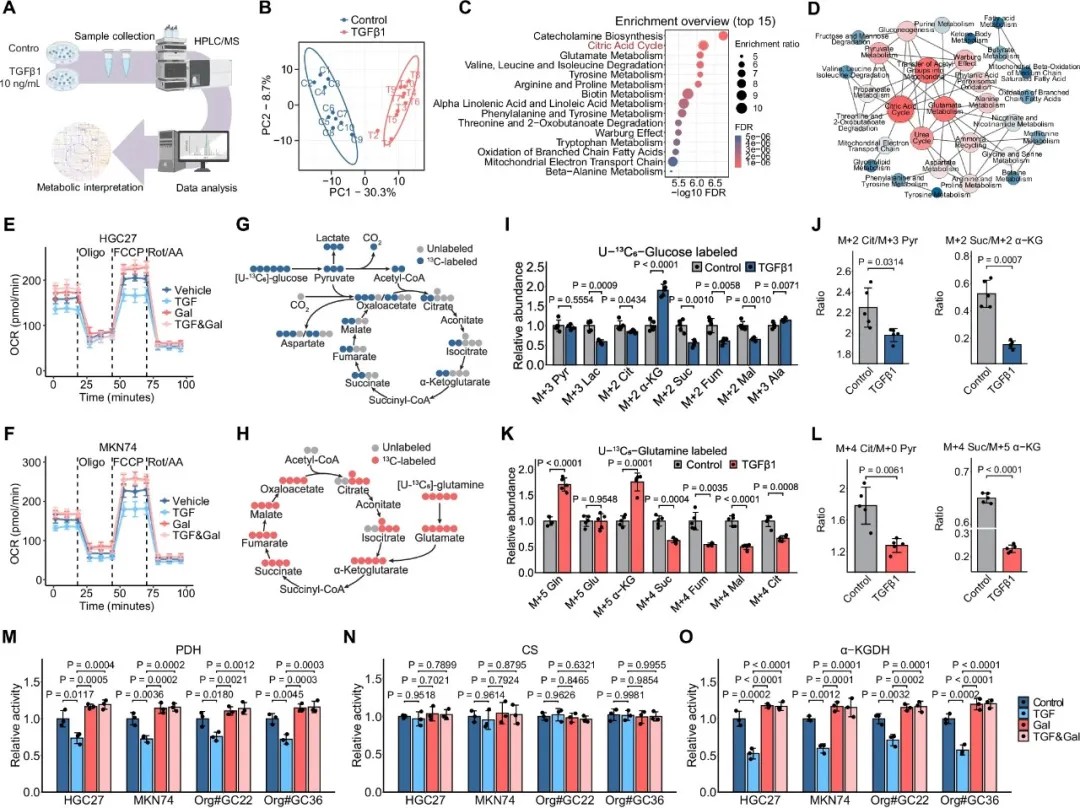
TGF-β通过抑制TCA循环酶PDH和α-KGDH来限制胃癌代谢
研究通过对12对胃癌组织、癌旁正常组织和腹膜转移样本进行RNA测序分析,研究人员发现上皮间质转化(EMT)是胃癌进展过程中最显著激活的路径之一,而TGF-β通路是EMT的关键驱动因子。
临床数据分析显示,TGFB1和TGFBR1在胃癌组织中表达上调,且与患者总体生存率差相关。然而,当研究人员在胃癌原位患者来源异种移植(PDX)模型中使用两种TβR1抑制剂(galunisertib和vactosertib)进行干预时,却观察到了矛盾结果:尽管治疗减少了转移灶数量,却未能改善生存率。更令人惊讶的是,18FDG PET/CT扫描显示,虽然抗TGF-β治疗降低了转移信号,但原位肿瘤表现出更快的生长和更高的代谢活性。这表明单纯阻断TGF-β信号可能产生促肿瘤生长的意外效应。
机制突破:TGF-β如何通过代谢调控抑制肿瘤

DLD-K430去乙酰化介导TGFβ驱动的PDH/α-KGDH抑制和胃癌细胞生长抑制

DLD-K430乙酰化促进DLD二聚化及PDH/α-KGDH复合物的组装
为探究这一现象背后的机制,研究人员将目光投向肿瘤代谢领域。非靶向代谢组学分析显示,TGF-β1处理后的胃癌细胞代谢特征发生显著改变,三羧酸循环(TCA)通路尤其受到严重影响。
通过进一步实验,团队发现TGF-β1能同时抑制丙酮酸脱氢酶(PDH)和α-酮戊二酸脱氢酶(α-KGDH)的活性——这是TCA循环中的两个关键酶。深入研究揭示,这两种酶共享一个共同的E3组分:二氢硫辛酰胺脱氢酶(DLD)。
DLD是能量代谢中的核心分子。研究人员发现,TGF-β通过调节DLD第430位赖氨酸(K430)的乙酰化水平,影响DLD的二聚化及与PDH和α-KGDH酶复合体的组装,从而调控整个TCA循环通量。研究人员还成功制备了特异性识别DLD-K430乙酰化的抗体,并证实其在胃癌组织中的表达水平低于癌旁正常组织,在腹膜转移灶中最低,且与患者预后呈正相关。
乙酰化是一种动态可逆的蛋白质翻译后修饰,那么TGF-β如何调控DLD-K430的乙酰化水平?研究人员通过质谱分析发现,乙酰辅酶A乙酰转移酶1(ACAT1)是催化DLD-K430乙酰化的关键酶。
正常情况下,ACAT1位于线粒体内,可乙酰化DLD并增强其活性。而TGF-β刺激后,ACAT1发生从线粒体到细胞核的转位,无法再接触位于线粒体的DLD,从而导致DLD-K430乙酰化水平降低。
这一发现不仅解释了TGF-β如何调控DLD乙酰化,还揭示了代谢酶与信号通路之间的全新交互机制。

TGFβ1通过SMAD3/4依赖的ACAT1线粒体-核转位降低DLD-K430乙酰化
双重靶向:联合治疗突破耐药困境
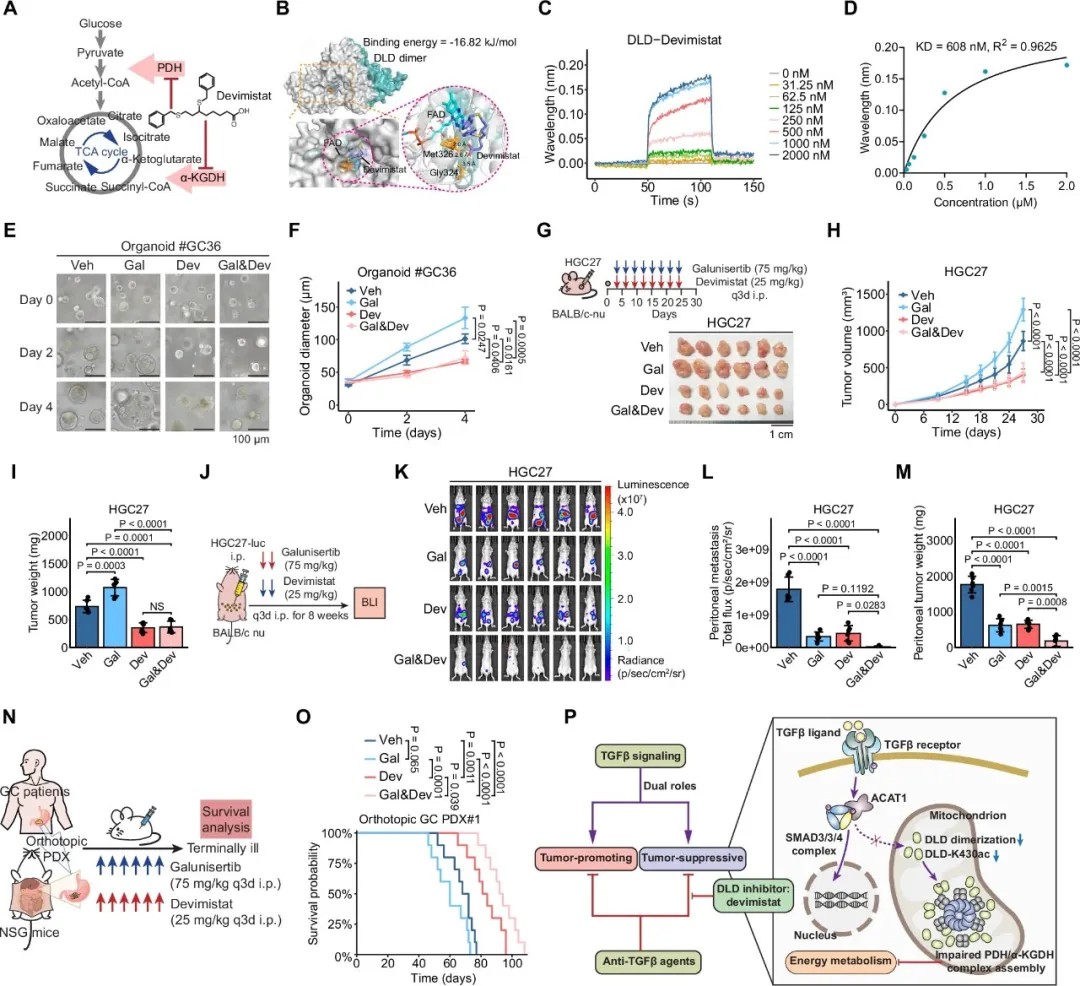
双重靶向DLD和TGF-β信号可增强胃癌模型的疗效
基于上述发现,研究团队提出了一个创新性的治疗策略:同时靶向TGF-β信号和DLD代谢活性,以克服单一靶向TGF-β治疗的局限性。
研究人员使用了devimistat,一种脂酸类似物,可有效抑制PDH和α-KGDH复合物的活性。实验表明,devimistat能够与DLD直接结合。在体外实验中,devimistat有效抵消了galunisertib(TβR1抑制剂)对胃癌细胞生长的促进作用。更为重要的是,在胃癌原位PDX模型中,galunisertib和devimistat联合治疗显著抑制了肿瘤生长,并实现了肿瘤消退。
在腹膜转移和肺转移模型中,联合治疗同样显示出卓越的抗转移效果。机制上,devimistat通过抑制DLD活性,阻断了TGF-β抑制被解除后可能引发的代谢重编程,从而遏制了肿瘤的进展。
这种联合策略有效解决了抗TGF-β治疗引发的代谢适应性问题,为临床耐药提供了有前景的解决方案。针对TGF-β和DLD的双重靶向治疗在多种胃癌模型中都显示出显著效果。随着更多研究的推进,这一联合策略有望为胃癌患者提供新的治疗选择。
该研究不仅揭示了TGF-β通路在胃癌中的新机制,更启示我们在肿瘤治疗中需全面考虑信号通路的双向性,避免单一干预可能带来的意外后果。(转化医学网360zhyx.com)
原文链接:
https://www.nature.com/articles/s41467-025-64997-5
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
责任声明:本稿件如有错误之处,敬请联系转化医学网客服进行修改事宜!
微信号:zhuanhuayixue
 腾讯登录
腾讯登录






还没有人评论,赶快抢个沙发