Cell Stem Cell | 中科院曾安团队合作揭示幼年心脏再生关键细胞,为重启成年心脏再生提供全新靶点
| 导读 | 该项研究工作得到了分子细胞科学卓越创新中心细胞生物学技术平台、化学生物学技术平台、动物实验技术平台和斑马鱼平台的支持。 |
11月7日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)曾安研究组与上海市第一人民医院周志刚团队在Cell Stem Cell发表题为“Injury-induced Clusterin⁺ cardiomyocytes suppress inflammation and promote regeneration in neonatal and adult hearts by reprogramming macrophages”的研究成果。研究鉴定出幼年哺乳动物心脏再生过程中具有核心调控作用的损伤诱导型 Clusterin⁺(Clu⁺)心肌细胞亚群,并揭示其通过重编程巨噬细胞、协调炎症消退与再生信号传递,驱动心肌修复的分子机制,为心梗后心脏再生提供了全新理论与技术路径。
在全球范围内,心血管疾病是导致人类死亡的首要原因,其中心肌梗死是最常见且最致命的类型之一。心肌梗死会引起大量心肌细胞不可逆死亡,伴随急性炎症反应和成纤维细胞活化,最终形成瘢痕组织,导致心室重构和心功能衰竭。与成年心脏再生能力缺乏不同,出生后短时间内的小鼠心脏仍具显著的再生潜能。例如,新生小鼠在心尖切除后可通过现存心肌细胞的增殖实现结构与功能的完全恢复,但这种能力会在出生后一周内迅速丧失。因此,阐明幼年心脏具备再生能力的细胞学机制,成为心脏再生研究领域的重要科学前沿。
研究团队通过对不同发育阶段小鼠心脏损伤后的单细胞转录组数据进行系统分析发现, Clu⁺ 心肌细胞仅在具有再生能力的新生期(P1)心脏中显著富集,而在P8及成年心脏中极为罕见。空间转录组分析进一步揭示,这些 Clu⁺ 细胞主要定位于损伤边缘区域,并与免疫细胞、增殖型心肌细胞和血管内皮细胞共同构建出利于修复的“再生生态位”。 双重组酶介导的遗传谱系追踪和细胞消融结果证实[2],Clu⁺ 心肌细胞仅在新生期损伤后诱导出现,而在未损伤或成年模型中几乎无法检测,其存在对幼年期心脏再生是必需的。显示Clu⁺ 心肌细胞是新生期特有的、损伤应答型再生心肌关键细胞亚群。

图1. 幼年期心脏再生特异性Clu⁺心肌细胞亚群的鉴定与遗传学示踪。
功能研究表明,Clusterin是该细胞群执行再生功能的核心基因。心肌细胞特异性敲除 Clu 不影响心脏发育,但会在损伤后显著抑制心肌细胞增殖、加剧纤维化,并导致心功能受损;相反,Clu过表达在P8及成年心脏中可显著促进心肌细胞增殖、减少瘢痕形成并改善收缩功能,且未诱导病理性肥厚或异常重构,显示出良好的安全性与再生促进作用。在分子机制上,CLU可直接结合巨噬细胞受体 TLR4,竞争性抑制损伤相关分子 HMGB1 介导的炎症激活,从而抑制过度炎症反应。并驱动巨噬细胞代谢重塑,使其向修复型表型转化。CLU显著扩增 Gpnmb⁺ 与 Arg1⁺ 抗炎巨噬细胞、减少炎性亚群,使其整体转录特征接近新生期再生心脏中的免疫状态,提示 CLU 对巨噬细胞表型具有显著的重编程作用。进一步研究发现,CLU诱导的巨噬细胞可分泌 BMP2,通过激活心肌细胞受体 BMPR1A 启动增殖信号,从而形成“心肌细胞–免疫细胞–再生信号”的调控闭环。
临床相关性分析显示,心肌梗死患者血清 CLU 水平显著下降,并与心功能受损程度密切相关。基于此发现,研究团队构建了高表达 CLU 的工程化人多能干细胞来源心脏类器官,并将其移植至心梗小鼠的损伤边缘区。结果显示,CLU⁺ 类器官可稳定存活并显著促进心肌细胞增殖、提升心脏功能,形成抗炎修复微环境。这一策略展示了工程化再生类器官在心肌梗死再生治疗中的转化潜力,为重建心肌功能提供了新的干预模式。目前,相关研究正向临床前验证阶段推进。
本研究识别出调控心脏再生的关键细胞群——Clu⁺心肌细胞,并揭示其通过心肌–免疫互作驱动组织修复的分子机制。研究团队进一步提出基于 CLU⁺ 类器官 的心肌修复策略,为恢复成年心脏的再生潜能提供了新的理论依据与技术方向。该成果从细胞和分子层面回答了“为何新生心脏能再生而成年心脏失去再生潜能”的核心问题。研究发现,成年心脏并非完全不可塑,而是存在可被重新激活的潜在再生程序。通过以特定心肌细胞状态为靶点,并调控其代谢与免疫微环境,研究提出了促进心脏再生的新策略,突破了以往仅从心肌增殖或免疫抑制单一角度干预的局限。利用工程化 CLU⁺ 类器官实现功能恢复的结果,展示了从基础机制到临床转化的可行路径,为重启哺乳动物心脏再生提供了新的理论基础与潜在靶点。
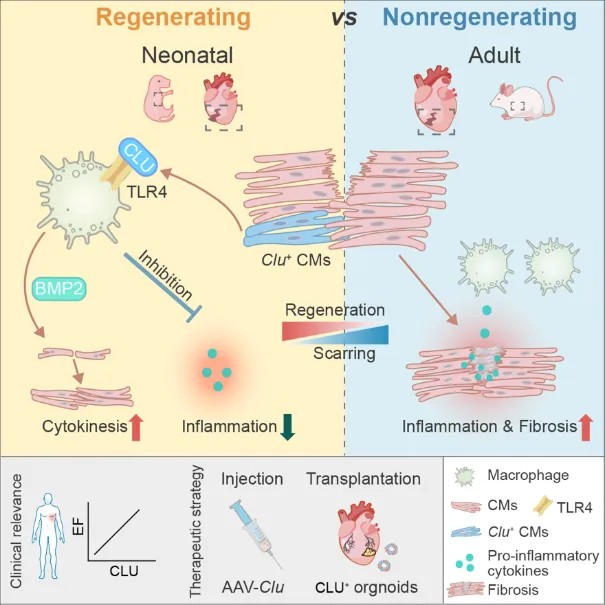
图2. Clu⁺心肌细胞亚群通过释放CLU蛋白促进心脏再生的分子机制
中国科学院分子细胞科学卓越创新中心范磊博士后、博士研究生唐琦、博士研究生王钰童为该论文的共同第一作者。中国科学院分子细胞科学卓越创新中心曾安研究员和上海交通大学医学院附属第一人民医院周志刚副主任医师为该论文的共同通讯作者。该项研究工作得到了科技部重点研发,国家自然科学基金、中国科学院战略性先导科技专项、上海市科学技术委员会,生物医学峰基金等资助。该项研究工作得到了分子细胞科学卓越创新中心细胞生物学技术平台、化学生物学技术平台、动物实验技术平台和斑马鱼平台的支持。(转化医学网360zhyx.com)
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
责任声明:本稿件如有错误之处,敬请联系转化医学网客服进行修改事宜!
微信号:zhuanhuayixue
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发