杨正林院士领衔!单细胞测序绘制原发性开角型青光眼系统免疫全景图,首次揭示循环免疫双重失调致视网膜神经节细胞损伤新机制
| 导读 | 这一发现为原发性开角型青光眼的发病机制提供了全新视角,也为精准治疗指明了方向。 |
近日,四川省人民医院杨正林院士/黄璐琳教授团队等在国际权威期刊《信号转导与靶向治疗》(Signal Transduction and Targeted Therapy,IF=52.7)发表了一项关于原发性开角型青光眼(POAG)的最新研究成果。该研究通过对110名原发性开角型青光眼患者及110名健康对照的外周血单个核细胞(PBMCs)进行单细胞RNA测序(scRNA-seq),结合基因组学与功能验证,首次揭示了原发性开角型青光眼患者循环免疫系统的双重失调——不仅存在免疫细胞组成的重塑,更出现炎症与神经保护信号的双向紊乱;同时,关键细胞因子(TNF、IFNG)的遗传调控异常,进一步加剧了视网膜神经节细胞(RGC)的脆弱性。这一发现为原发性开角型青光眼的发病机制提供了全新视角,也为精准治疗指明了方向。
青光眼的免疫盲区:从眼内压到系统免疫的突破

单细胞转录组测序分析揭示POAG患者外周免疫细胞组成及基因表达异常
原发性开角型青光眼(POAG)是全球不可逆失明的首要原因,影响超7000万人,其中10%患者最终双眼失明。长期以来,学界普遍认为眼内压(IOP)升高是其核心风险因素,但临床数据显示,约30%高眼压人群不会发展为POAG,而部分正常眼压患者仍会出现视网膜损伤。这一矛盾提示,系统免疫的参与可能是被忽视的关键。过去十年的研究,逐渐意识到免疫系统在神经退行性疾病中的作用,但POAG患者的循环免疫状态究竟如何?遗传风险如何转化为免疫细胞的功能异常?这些问题一直没有明确答案。研究团队的研究填补了此项空白——从单细胞水平解析POAG的系统免疫图谱,并连接遗传风险与临床表型。
核心发现一:原发性开角型青光眼(POAG)患者的循环免疫细胞重新洗牌

单细胞转录组测序揭示POAG患者免疫细胞亚群组成改变
研究团队首先对220份外周血单个核细胞样本进行scRNA-seq,鉴定出五大免疫细胞亚群(CD4+ T、CD8+ T、NK、B、髓系细胞),并对比POAG患者与健康对照的细胞组成差异:
-
CD4+ T细胞:比例显著升高,其中 regulatory T细胞(Tregs)、Th2细胞、细胞毒性CD4+ T细胞均增加,而初始CD4+ T细胞、Th1细胞减少;
-
CD8+ T细胞:总比例下降,效应GZMK+ T细胞(负责细胞毒性)大幅减少,过渡态细胞增多;
-
NK细胞:总比例降低,但无明显亚群差异;
-
B细胞:记忆B细胞、双阴性(DN)B细胞减少,而生发中心来源的记忆B细胞、自身反应性DN B细胞增加;
-
髓系细胞:经典/中间单核细胞、巨噬样细胞增多,树突状细胞(DCs)减少。
这些变化提示,原发性开角型青光眼(POAG)患者的免疫系统从防御状态转向失衡状态——一方面,记忆与调节性T细胞、单核细胞等促炎/稳态细胞扩张;另一方面,负责清除异常细胞的细胞毒性CD8+ T细胞、NK细胞减少。
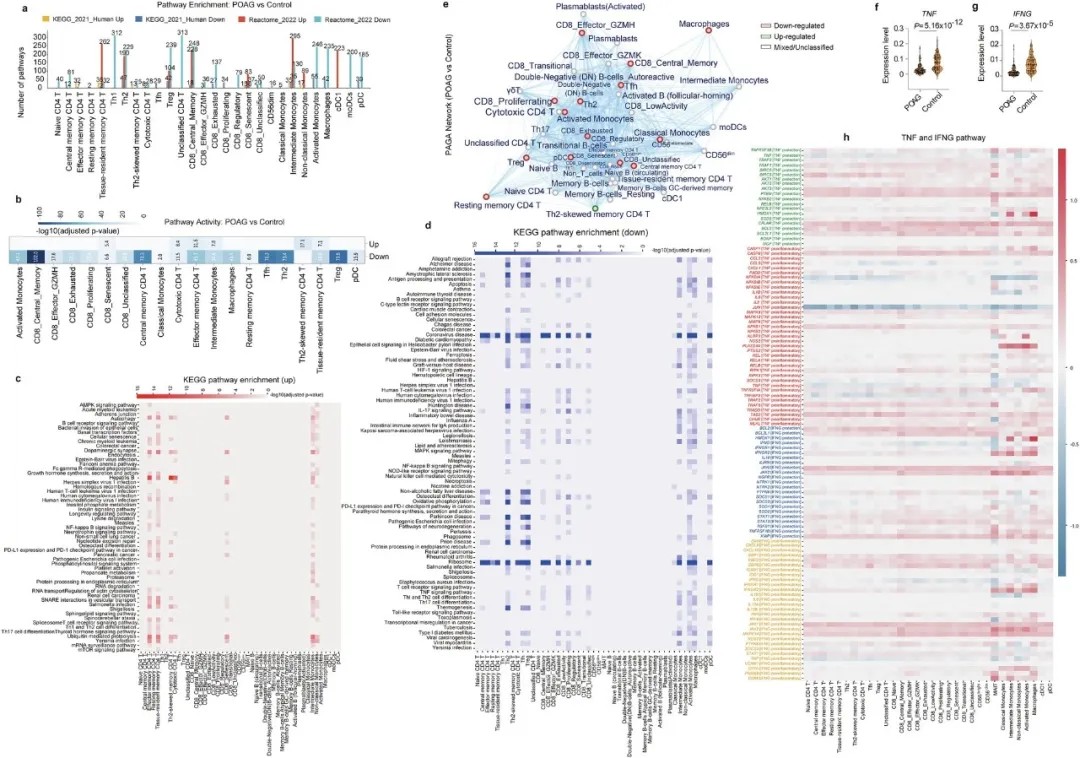
POAG患者循环免疫细胞存在广泛且细胞类型特异性的通路失调
核心发现二:炎症与神经保护的双向战场:TNF与IFNG通路的双重失调

高眼压与正常眼压POAG患者免疫细胞组成及通路失调的对比分析
进一步分析细胞内的基因表达,研究团队发现了更关键的矛盾:原发性开角型青光眼(POAG)患者的免疫细胞中,炎症与神经保护信号同时被激活。
全局来看,TNF、IFNG等核心细胞因子的表达显著下调;但在特定细胞亚群中,炎症激活成分上调,而神经保护基因也同时增强——尤其是在调节性T细胞、记忆T细胞和单核细胞中。
这就像一场拉锯战:系统整体试图抑制过度炎症,但局部细胞仍在激活防御机制,同时又释放神经保护信号试图挽救视网膜神经节细胞(RGC)。这种双向失调可能导致免疫系统无法有效平衡抗炎与护神经,最终加剧视网膜损伤。

基于机器学习的POAG基因表达特征预测模型
遗传层面:GWAS位点瞄准特定免疫细胞,调控网络重构


细胞类型特异性eQTL定位揭示POAG中免疫细胞的情境依赖遗传调控
为了连接遗传风险与免疫功能,研究团队整合了POAG的全基因组关联研究(GWAS)数据与单细胞eQTL(表达数量性状位点)分析,发现:
-
POAG的遗传风险位点并非泛泛调控,而是细胞类型特异性的——例如,某些位点仅影响CD4+ T细胞的基因表达,另一些则作用于髓系细胞;
-
关键细胞因子通路(如TNF、IFNG)的调控基因(如MASP2、EMX1)在NK细胞、B细胞中存在“遗传-表达”关联,提示这些基因的变异可能通过改变免疫细胞功能,增加POAG风险。
比如,某个GWAS风险位点的变异,可能只影响NK细胞中NXPH3基因的表达,进而削弱NK细胞的细胞毒性,最终导致RGC更容易受损。这解释了为什么同样的遗传风险,在不同人身上会表现为不同的免疫异常。

SMR分析揭示细胞类型特异性基因表达遗传调控与POAG风险相关
功能验证:小鼠模型证实——TNF/IFNG失衡是视网膜损伤的催化剂

IFNG或TNF基因缺陷加剧LPS/NMDA诱导损伤模型中的视网膜神经退行性变及视觉功能障碍
为了验证上述发现的临床相关性,研究团队构建了Ifng基因敲除(Ifng-/-)和Tnf杂合缺失(Tnf+/-)小鼠,并用LPS/NMDA诱导视网膜损伤模型(模拟POAG的神经炎症环境):
-
与野生型小鼠相比,Ifng-/-小鼠的RGC丢失增加,视觉功能(VEP、ERG)更差,且胶质细胞反应(GFAP、IBA1)减弱;
-
Tnf+/-小鼠同样出现RGC丢失加剧,尽管视觉行为无明显变化,但视网膜电生理与分子指标显示更严重的损伤。
这说明,即使只是削弱TNF或IFNG的信号,也会打破视网膜的保护-损伤平衡,让视网膜神经节细胞更易受到伤害。这直接证明了研究团队观察到的系统免疫失调,确实会转化为视网膜的病理损伤。
研究意义与未来展望
该研究的突破在于,首次建立了原发性开角型青光眼系统免疫图谱,并将遗传风险、免疫细胞功能与视网膜损伤直接关联。其意义不仅在于揭示机制,更在于为治疗提供了新靶点:
-
告别一刀切抗炎:针对特定免疫细胞亚群(如CD8+ T细胞、NK细胞)的神经保护通路进行调节,而非广泛抑制炎症;
-
遗传导向的精准干预:通过检测患者的GWAS风险位点与免疫细胞eQTL,预测其对TNF/IFNG通路药物的响应,实现个性化治疗。
过去我们盯着眼内压,现在发现,调节系统免疫的平衡同样重要。比如,如果能恢复CD8+ T细胞的细胞毒性,或增强NK细胞的清除功能,可能比单纯降眼压更能延缓视网膜神经节细胞死亡。随着对循环免疫系统双重失调的深入理解,有望迎来更精准、更有效的青光眼治疗策略,让更多患者保住光明。(转化医学网360zhyx.com)
原文链接:
https://www.nature.com/articles/s41392-025-02438-x
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发