重磅研究!黄晓军院士领衔破解造血干细胞植入功能不良难题,揭示TGF-β1信号异常的关键机制,发现潜在治疗药物
| 导读 | 该研究不仅阐明了骨髓血管微环境紊乱的分子逻辑,还为改善移植后造血恢复提供了潜在治疗靶点。 |
造血干细胞移植(HSCT)是治疗白血病、再生障碍性贫血等血液系统疾病的重要手段,但约30%的患者会遭遇植入功能不良(PGF)——移植后骨髓无法正常重建造血功能,患者需长期输血或面临感染风险。近日,北京大学人民医院黄晓军院士/孔圆教授、中国科学院遗传与发育生物学研究所汪迎春教授团队等一项发表于《信号转导与靶向治疗》(Signal Transduction and Targeted Therapy,IF=52.7)的重磅研究,揭开了植入功能不良背后的关键机制:TGF-β1信号异常激活,导致骨髓内皮细胞(BM ECs)适应不良,丧失对造血干细胞的支撑功能。该研究不仅阐明了骨髓血管微环境紊乱的分子逻辑,还为改善移植后造血恢复提供了潜在治疗靶点。
临床痛点:骨髓内皮细胞是造血恢复的幕后工程师

TGF-β1激活诱导骨髓内皮细胞损伤
骨髓中的血管内皮细胞并非简单的结构支架,而是造血微环境的调控中枢——它们通过分泌血管活性因子(如PTN、KITLG),为造血干细胞提供存活信号,并引导其分化为成熟的血细胞。然而,化疗、放疗或移植后的炎症反应,常导致骨髓内皮细胞受损。若损伤是可逆的,内皮细胞可通过增殖、迁移修复血管;但如果陷入适应不良的修复状态,它们会失去原有的造血支持功能,甚至转化为促纤维化表型,最终阻碍造血重建。临床中常见到,有些患者移植后骨髓血管看似长好了,但就是不造血,这项研究就是要搞清楚,为什么这些内皮细胞不起作用?
研究揭秘:TGF-β1是内皮适应不良的推手

骨髓内皮细胞中TGF-βRI过表达加剧内皮损伤并延迟小鼠造血恢复
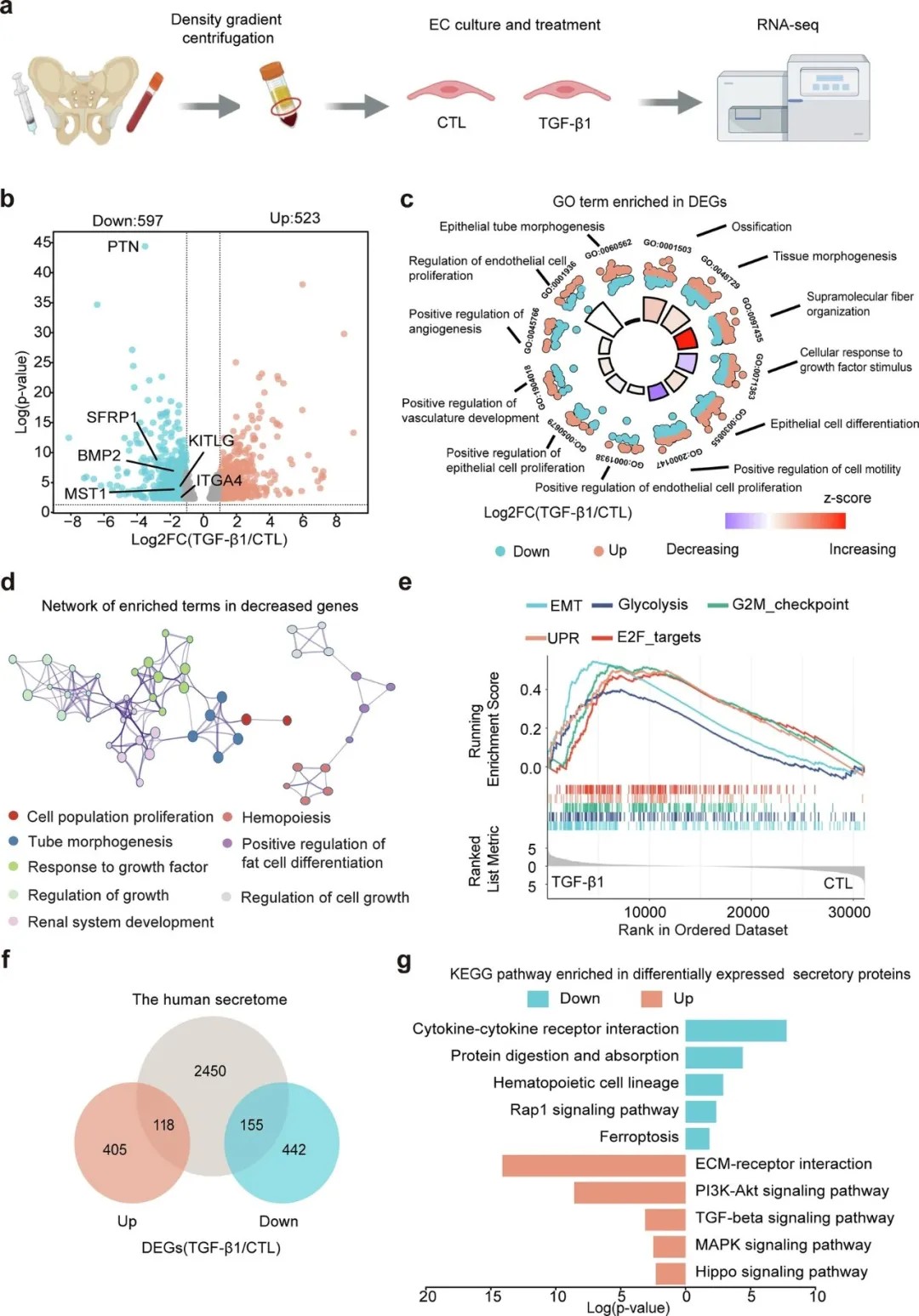
RNA测序分析显示,TGF-β1处理诱导骨髓内皮细胞分泌组变化
为了回答这个问题,研究团队从体外实验、小鼠模型和临床样本三个层面展开:
1. 体外实验证实:TGF-β1直接抑制内皮功能与造血支持
研究人员用重组TGF-β1处理健康供者的骨髓内皮细胞,发现随着浓度升高,内皮细胞的迁移能力(成管实验)下降了40%(p<0.0001),造血支持能力(通过共培养CD34+造血干细胞,检测集落形成单位)也显著减弱——CFU-E(红系祖细胞)、BFU-E(爆式红系集落)等关键指标下降了30%-60%。更关键的是,当研究人员用siRNA沉默TGF-β受体I(TGF-βRI)后,这种损伤被完全逆转:内皮细胞的迁移、成管能力恢复至正常水平,造血支持功能也回升。这说明TGF-β1信号是导致内皮功能障碍的直接原因。
2. 小鼠模型:内皮特异性TGF-β1过表达,复制了PGF的病理过程
为了模拟临床中的慢性损伤,研究团队用腺相关病毒(AAV)介导,在小鼠BM ECs中过表达持续激活的TGF-βRI(T204D突变体)。随后给小鼠注射化疗药5-FU(模拟移植后的骨髓损伤),结果发现:
-
过表达TGF-βRI的小鼠,外周血白细胞、血小板恢复时间比对照组延迟了5-7天;
-
骨髓内皮细胞数量减少了50%(流式细胞术检测),血管结构破坏严重;
-
造血干细胞(HSPCs)和髓系祖细胞数量下降了60%以上。
这完全复制了人类植入功能不良的病理特征——内皮细胞坏了,造血就无从谈起。
3. 多组学分析:TGF-β1重塑内皮分泌组,阻断关键信号通路
为了弄清楚TGF-β1如何改变内皮细胞的功能,研究团队做了转录组+磷酸化蛋白质组分析:
-
转录组发现,TGF-β1处理后,内皮细胞中造血支持因子的基因表达大幅下降——比如促进造血干细胞增殖的PTN(pleiotrophin)下降了87%(p<0.001),支持粒细胞生成的KITLG下降了63%;而促纤维化因子(如SNAI2、VIM)的表达上升了2-3倍。
-
磷酸化蛋白质组则揭示,TGF-β1激活了VEGFR/Notch信号通路的紊乱,导致p38α MAPK持续磷酸化(激活)。p38α是已知的EMT(内皮-间质转化)驱动因子,它的激活进一步推动了内皮细胞的适应不良。

无论是TGF-β1通路抑制还是造血干细胞活性血管分泌因子多效生长因子(PTN)处理,均可在体外修复适应不良的骨髓内皮细胞
既然TGF-β1是罪魁祸首,那么抑制它是否能拯救内皮细胞?
1. 小鼠实验:TGF-β受体抑制剂让造血恢复加速
研究人员给过表达TGF-βRI的小鼠注射TGF-β受体激酶抑制剂LY2157299,结果发现:外周血细胞计数恢复速度与对照组持平;骨髓内皮细胞数量增加了35%,血管结构改善;HSPCs和髓系祖细胞数量回升至正常的70%以上。
这说明抑制TGF-β1通路,能有效逆转内皮的适应不良状态,恢复造血支持功能。
2. 临床研究:luspatercept让48%的患者实现多系造血改善
为了验证这一结论的临床价值,研究团队开展了一项前瞻性单臂临床试验,纳入64例移植后造血恢复不良的患者(PGF或GGF早期患者),给予TGF-β配体陷阱药物luspatercept(已获批用于MDS、地中海贫血的红系成熟)。结果显示:
-
红细胞改善(HI-E):35.9%的患者达到(血红蛋白升高≥1g/dL或输血依赖减少);
-
多系改善:48.4%的患者实现了中性粒细胞(HI-N)或血小板(HI-P)的改善——其中16例中性粒细胞<1×10^9/L的患者,100%达到了HI-N;20例血小板<100×10^9/L的患者,40%达到了HI-N。
这些数据表明,luspatercept通过抑制TGF-β1通路,修复了骨髓内皮细胞的功能,从而促进了多系造血恢复。

luspatercept在移植后造血重建不良患者中的临床评估

TGF-β1调控的磷酸化事件时间解析
临床意义与未来展望

植入功能不良患者骨髓内皮细胞中过度激活的TGF-β1通路
这项研究的突破在于,首次明确了TGF-β1信号是骨髓内皮细胞适应不良的驱动者,并将其与临床常见的植入功能不良关联起来。更重要的是它证明:靶向骨髓血管微环境(而非直接刺激造血干细胞),能有效促进造血恢复。过去治疗移植后造血不良,多是给患者输血小板、红细胞,或者用细胞因子刺激干细胞。现在我们知道,修复内皮细胞这个土壤,才能让干细胞发芽。luspatercept的临床数据给了研究团队信心——未来可能会有更多TGF-β1抑制剂,用于改善移植后或化疗后的造血恢复。这项研究为骨髓血管微环境的研究打开了一扇新窗口,也为临床治疗提供了极具潜力的靶点。(转化医学网360zhyx.com)
原文链接:
https://www.nature.com/articles/s41392-025-02429-y
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
责任声明:本稿件如有错误之处,敬请联系转化医学网客服进行修改事宜!
微信号:zhuanhuayixue
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发