“双管齐下”新进展!上海交大联合同济发文:揭示引起的结直肠癌进展新机制
| 导读 | 结直肠癌(CRC)是一个普遍存在的全球健康问题,发病率排名第三,对人类生命健康构成重大威胁。 |
11月14日,上海交通大学医学院研究团队和同济大学医学院团队在期刊《Clinical and Translational Medicine》上发表题为“Loss of SETD2 aggravates colorectal cancer progression caused by SMAD4 deletion through the RAS/ERK signalling pathway”的研究论文,研究发现SETD2介导的H3K36me3通过促进SMAD4缺陷CRC中DUSP7的转录来抑制RAS/ERK信号通路,这为晚期CRC的治疗提供了潜在的治疗靶点。

https://onlinelibrary.wiley.com/doi/full/10.1002/ctm2.1475
研究背景
01
结直肠癌(CRC)是一种复杂多变的多步骤疾病,由基因突变和表观遗传改变相互作用引起。组蛋白 H3K36 三甲基转移酶含 SET 结构域2(SETD2)作为一种表观遗传信号分子,在 CRC 中的突变率为 5%。SETD2 表达在人 CRC 和用偶氮甲烷/葡聚糖硫酸钠 (AOM/DSS) 处理的小鼠的发育中降低。SETD2 的缺失促进了 CRC 的发展。SMAD 家族成员 4 (SMAD4) 在 CRC 中的突变率为 14%,SMAD4 消融导致 CRC。SETD2 和 SMAD4 的共突变可预测晚期 CRC。然而,人们对 SETD2 和 SMAD4 的潜在协同作用知之甚少。
组蛋白修饰是重要的表观遗传调控形式之一。含有 SET 结构域2(SETD2) 是唯一已知的 H3K36 三甲基转移酶,在 CRC 样本中频繁突变(5%)。 SETD2在 UC中的突变率高达 17%。SETD2介导的H3K36三甲基化参与一系列细胞过程,包括DNA损伤修复,转录调控和选择性剪接。SETD2包括几个结构域,其中SET结构域发挥蛋白质甲基转移酶活性。据报道,SETD2在肿瘤中起抑制作用,如肾癌,胃癌,结肠癌和胰腺癌。SETD2 通过调节可变剪接体以抑制 WNT 通路上游的 DVL2 来抑制 WNT 信号通路并抑制小肠肿瘤的形成。SETD2 的缺失有助于侵袭性胃肠道间质瘤的发展,SETD2 通过调节氧化应激相关因子来抑制肠上皮损伤, SETD2 还在抑制上皮愈合中发挥作用。此外,SETD2已在许多发育领域进行了研究,涉及精子发育、V(D)J 重组、骨髓间充质干细胞分化、MDS 相关白血病的发生和不良预后、肝脂质代谢的调节及其在胚胎发育中的作用。然而,H3K36 三甲基转移酶 SETD2 在 TGF-β 信号缺陷诱导的 CRC 中的作用仍然未知。
研究进展
02
为了研究SETD2是否加剧了SMAD4-dificient CRC,我们首先查阅了TCGA数据库中CRC的临床数据样本,并分析了CRC患者样本中SETD2和SMAD4的表达水平及其与癌症分期和生存率的关系。结果显示,在CRC患者中,SETD2的突变率为5%,SMAD4的突变率为14%(图1A)。TCGA数据库显示,CRC患者中SETD2和SMAD4 mRNA表达水平之间证实了一定的相关性(图1B)。此外,晚期CRC患者的SETD2和SMAD4共突变率显著增加(图1C和D),而表现出SETD2和SMAD4共突变的患者的临床生存过程较差(图1E)。这些结果表明,SETD2和SMAD4的缺乏促进了CRC向更晚期的进展,强调了SETD2和SMAD4在CRC发病机制中的重要作用。
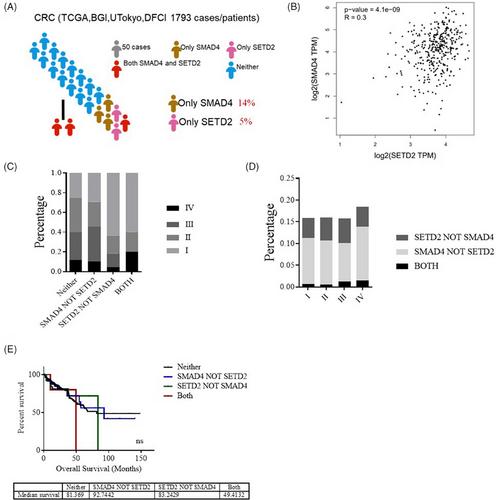
晚期结直肠癌患者SETD2和SMAD4突变的共现率升高
研究结论
03
为了探讨在没有 SMAD4 的情况下,SETD2 缺陷是否促进晚期 CRC,我们生成了具有肠上皮细胞(IEC)特异性 SETD2 和 SMAD4 突变的小鼠模型,我们发现 SETD2 缺陷会加剧 SMAD4 突变型 CRC。从机制上讲,我们的研究结果强调 SETD2 是通过 RAS/ERK 信号通路在 SMAD4 缺陷 CRC 中的关键表观遗传调节因子。
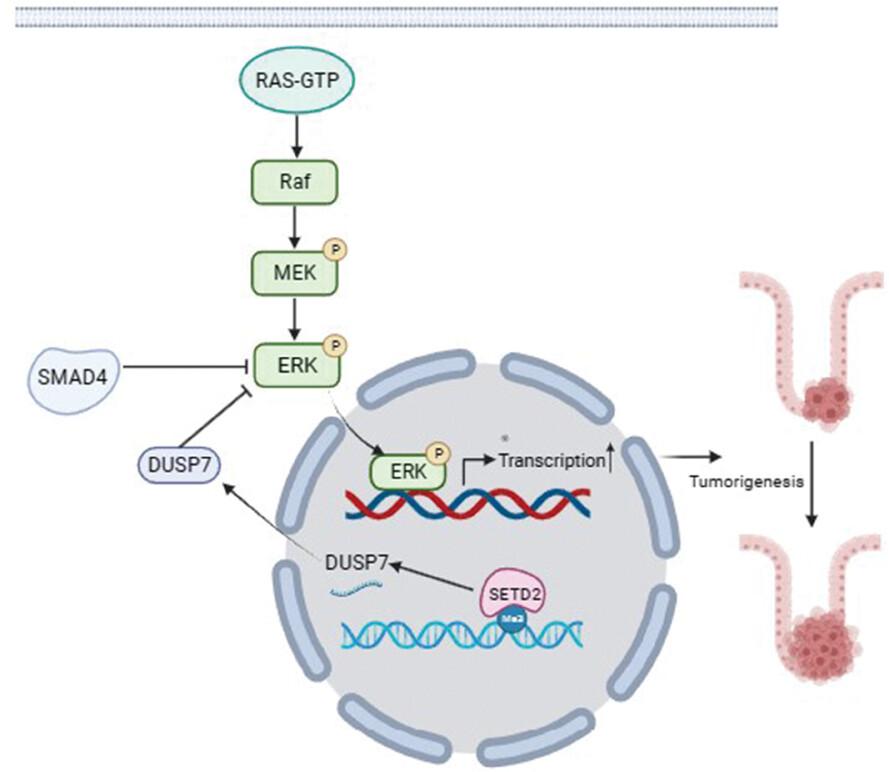
总之,研究结果表明,SETD2通过促进SMAD4缺陷型CRC中DUSP7的转录来抑制RAS/ERK信号通路,为晚期CRC的治疗提供潜在的治疗靶点。(转化医学网360zhyx.com)
参考资料:
https://onlinelibrary.wiley.com/doi/full/10.1002/ctm2.1475
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发