让肿瘤“无处可逃"! 南京医科大学/中国药科大学合作发文: 发现靶向治疗耐药新策略
| 导读 | 在肺腺癌(LUAD)使用奥希替尼治疗中,获得性耐药不可避免,但其潜在机制仍知之甚少。 |
近日,南京医科大学/中国药科大学合作共同在期刊《Journal of Experimental & Clinical Cancer Research》发表了研究论文,题为“Hypoxia-inducible APCDD1L-AS1 promotes osimertinib resistance by stabilising DLST to drive tricarboxylic acid cycle in lung adenocarcinoma”,本研究报告称,长链非编码 RNA(lncRNA)APCDD1L-AS1 在奥希替尼耐药的肺腺癌(LUAD)组织和细胞中表达上调,并与奥希替尼耐药的 LUAD 患者的生存期缩短有关。数据表明,APCDD1L-AS1 表达上调是奥希替尼耐药 LUAD 患者总生存期的独立风险因素。APCDD1L-AS1 敲低在体外和体内均增强了奥希替尼的敏感性,而 APCDD1L-AS1 过表达则促进了奥希替尼耐药性。总之,本数据证实,APCDD1L-AS1 由缺氧诱导的 HIF-1α 上调,通过稳定 DLST 来驱动 TCA 循环,从而进一步促进 LUAD 中的奥希替尼耐药性。本研究结果为 HIF-1α/APCDD1L-AS1/DLST 轴相关重编程在低氧和三羧酸循环平衡中赋予 LUAD 对奥希替尼耐药性的作用提供了新的见解,并证实了靶向 APCDD1L-AS1 的治疗潜力。

https://jeccr.biomedcentral.com/articles/10.1186/s13046-025-03462-z#Sec32
背景知识
01
肺癌是全球最常见的恶性肿瘤之一,死亡率很高。肺腺癌(LUAD)是肺癌的主要组织学亚型,约 40% 的亚洲 LUAD 患者携带表皮生长因子受体(EGFR)酪氨酸激酶结构域的激活突变。EGFR 酪氨酸激酶抑制剂(TKIs),包括第一代(吉非替尼和厄洛替尼)、第二代(阿法替尼)和第三代(奥希替尼)TKIs,已被推荐作为全球晚期 LUAD 患者携带激活 EGFR 突变的标准一线治疗药物。然而,患者不可避免地会对 EGFR-TKIs 产生获得性耐药,这限制了这些 TKIs 在治疗 EGFR 突变型 LUAD 中的疗效。奥希替尼被广泛用于治疗在使用其他 EGFR-TKIs 治疗期间出现疾病进展的晚期 EGFR 突变型 LUAD 患者。然而,与其它 EGFR-TKIs 类似,奥希替尼耐药仍是 LUAD 治疗中的重大障碍。这些因素凸显了进一步探究奥希替尼耐药机制以及寻找更有效的治疗靶点以改善 EGFR 突变型肺腺癌患者预后的迫切需求。
研究进展
02
为了探究 APCDD1L-AS1 对体内奥希替尼耐药性的影响,研究人员构建了携带 shNC 和 sh-APCDD1L-AS1 的慢病毒载体,在评估了慢病毒 sh-APCDD1L-AS1 的转染效率后,研究人员将 PC9/OR 细胞感染 LV-sh-APCDD1L-AS1 或 LV-shNC,并皮下注射到 BALB/c 裸鼠体内,以建立肿瘤异种移植模型。奥希替尼治疗后,APCDD1L-AS1 敲低组的肿瘤明显小于其他组。LV-sh APCDD1L-AS1 加奥希替尼组的结节中 Ki-67 阳性细胞最少。这些数据表明,靶向 APCDD1L-AS1 可使奥希替尼耐药的 LUAD 细胞重新对奥希替尼敏感。
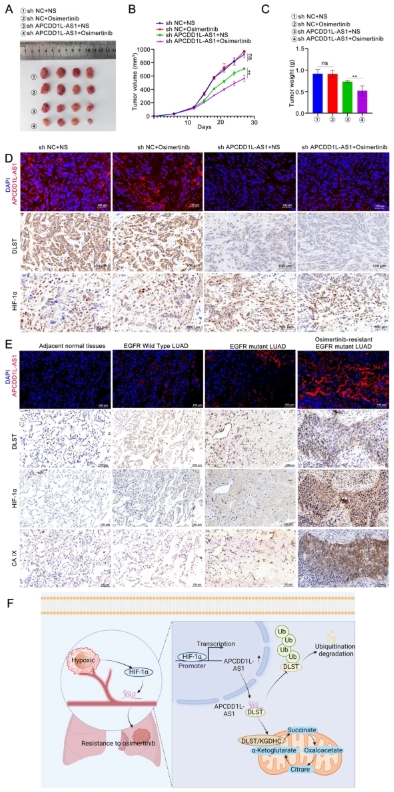
APCDD1L-AS1 的靶向作用使对奥希替尼耐药的肺腺癌细胞重新对奥希替尼敏感,并且其表达在体内与 DLST 和 HIF-1α 的表达呈正相关。
此外,CISH 和 IHC 分析证实,在肿瘤内部区域,APCDD1L-AS1 敲低组的 APCDD1L-AS1 和 DLST 阳性细胞明显少于对照组,而 HIF-1α 阳性细胞则无显著变化。在对照组肿瘤中,肿瘤内部区域的 HIF-1α 和 APCDD1L-AS1 水平显著高于肿瘤周边区域。随后,IHC 分析显示,与相邻正常组织相比,具有奥希替尼耐药性的 LUAD 组织中 HIF-1α 和缺氧标志物 CA IX 的表达水平显著上调。Kaplan-Meier 分析表明,CA IX 表达水平高的奥希替尼耐药 LUAD 患者的总生存期(OS)明显低于 CA IX 表达水平低的患者。这一观察结果强调了缺氧与奥希替尼耐药性发展之间的显著关联。此外,基于 CISH 和 IHC 染色,在奥希替尼耐药 LUAD 组织样本中,APCDD1L-AS1 表达与 DLST、HIF-1α 和 CA IX 表达呈正相关。总体而言,这些发现与我们的体外实验结果一致,表明 HIF-1α/APCDD1L-AS1/DLST 轴与奥希替尼耐药性有关。
结论
03
总体而言,本研究结果表明,低氧诱导的 HIF-1α 上调 APCDD1L-AS1 表达通过重新编程三羧酸循环使 LUAD 细胞对奥希替尼产生耐药性。在体内靶向 APCDD1L-AS1 显著增强了 PC9/OR 细胞对奥希替尼的敏感性。(转化医学网360zhyx.com)
参考资料:https://jeccr.biomedcentral.com/articles/10.1186/s13046-025-03462-z#Sec32
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
责任声明:本稿件如有错误之处,敬请联系转化医学网客服进行修改事宜!
微信号:zhuanhuayixue
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发