从逃逸到狙击!复旦大学/天津医科大学合作发文:对抗胰腺癌免疫逃逸的新靶点
| 导读 | PD-1已被证实可通过其磷酸化激活胰腺导管腺癌(PDAC)中的间质上皮转化因子(MET)通路。然而,MET 激活的免疫调节后果仍知之甚少。 |
7月17日,复旦大学/天津医科大学研究团队合作共同在期刊《Advanced Science》上发表了研究论文,题为“The Evolutionary Trajectory and Prognostic Value of GITR+ Tregs Reprogramed by Tumor-Intrinsic PD-1/c-MET Signaling in Pancreatic Cancer”,本研究证实了磷酸化 MET(p-MET)与肿瘤内在 PD-1 之间存在显著的正相关,两者均独立地与不良预后相关。p-MET 水平升高与 CD8+ T 细胞细胞毒性降低以及调节性 T 细胞(Treg)浸润增加相关。与 KLF2⁺初始 Tregs 相比,GITR⁺ Tregs 表现出活化表型,并增强了免疫调节标志物的表达。亚组分析进一步表明,GITR⁺ Treg 浸润增加削弱了血清 CA19-9 的预后效用,突显了这一 Treg 亚群的免疫抑制主导地位。从机制上讲,MET-IL-23-STAT4 轴协调了 PDAC 中 GITR⁺ Treg 介导的免疫逃逸。在体内,MET 抑制和 GITR 激动剂协同作用,增强原位 PDAC 模型中的抗肿瘤免疫。这些发现共同表明,MET 信号传导和 GITR⁺ 调节性 T 细胞是可作用的靶点,有助于对抗胰腺导管腺癌中的免疫逃逸,并提高免疫治疗策略的疗效。

https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202500806
背景知识
01
胰腺导管腺癌(PDAC)是一种极其凶险的癌症,全球发病率较低,但仍是致死率最高的恶性肿瘤之一,五年生存率低于 13%,且近年来发病率呈上升趋势。尽管免疫疗法在治疗多种癌症方面取得了显著进展,但其在 PDAC 治疗中的效果仍然有限。造成这种情况的原因是多方面的,其中一个主要因素是 PDAC 具有高度免疫抑制性的肿瘤微环境(TME)。这种 TME 富含肿瘤相关成纤维细胞、调节性 T 细胞(Tregs)和 M2 巨噬细胞等成分,这些成分有助于癌细胞逃避免疫系统。这些免疫抑制成分主要由肿瘤细胞与肿瘤免疫微环境(TIME)之间的相互作用驱动,包括 PD-1/PD-L1 轴、CXCL1/CXCR2 轴和 TGF-β/TGF-βR 轴等通路。靶向和调节这些相互作用或 TME 中的免疫抑制成分,为提高 PDAC 免疫疗法的有效性提供了有前景的策略。
MET 抑制与 GITR 激动剂联合应用的治疗潜力
02
为了评估靶向 MET-GITR⁺ 调节性 T 细胞轴的治疗相关性,研究人员采用了一种源自 KPC 的原位胰腺导管腺癌(PDAC)小鼠模型。鉴于先前的证据表明,GITR 激动剂能够削弱调节性 T 细胞介导的免疫抑制作用,同时增强效应 T 细胞的活性,研究人员给予 GITR 激动剂 DTA-1 与 MET 抑制剂 INC280 联合用药。
研究人员将小鼠随机分为四个治疗组:1)对照组(溶剂+IgG),2)INC280 单药治疗组(MET 抑制剂+IgG),3)DTA-1 单药治疗组(溶剂+GITR 激动剂),4)联合治疗组(INC280 + DTA-1)。两种单药治疗均显著降低了肿瘤负荷,而联合治疗则产生了最显著的肿瘤抑制效果。为评估免疫机制,研究人员对免疫细胞进行了流式细胞术检测。INC280 和 DTA-1 均显著降低了总调节性 T 细胞(Tregs)和 CD4⁺ T 细胞中 GITR⁺ Treg 的频率。尤其是,只有 INC280 降低了 CD4⁺ 细胞群中的总调节性 T 细胞数量,而联合治疗并未进一步增强调节性 T 细胞的耗竭,这表明 MET 抑制和 GITR 激动作用通过不同的且非冗余的机制发挥作用。
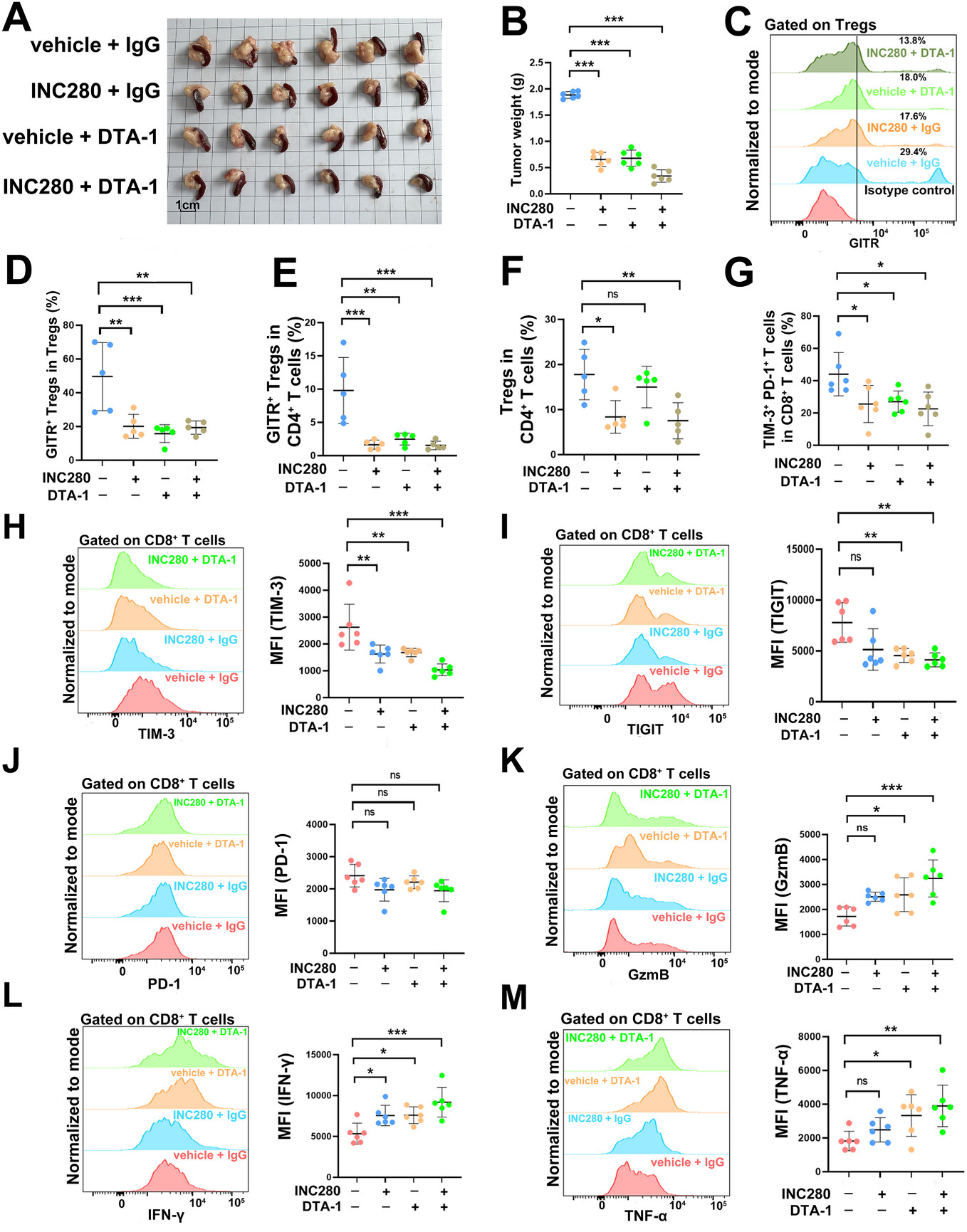
MET 抑制剂与 GITR 激动剂联合使用可抑制胰腺导管腺癌进展
对 CD8⁺ T 细胞的表型分析揭示了对耗竭和效应功能的不同影响。所有治疗组均显著减少了 TIM-3⁺PD-1⁺ 耗竭 CD8⁺ T 细胞。DTA-1 单药治疗降低了 TIGIT 和 TIM-3 的表达,而 INC280 选择性地下调了 TIM-3,对 TIGIT 或 PD-1 没有显著影响。尤其是,联合治疗显著增加了 CD8⁺ T 细胞的细胞毒性标志物,包括 GzmB、IFN-γ 和 TNF-α,同时减少了耗竭标志物,表明细胞毒性 T 细胞的功能重编程得到了增强。
综上,这些发现表明 MET 抑制和 GITR 激动剂协同作用可增强胰腺导管腺癌(PDAC)的抗肿瘤免疫。INC280 主要通过靶向免疫抑制性调节性 T 细胞(Treg)发挥作用,而 DTA-1 则有助于恢复 CD8⁺ T 细胞的效应功能并缓解其耗竭。联合治疗具有累加的免疫调节作用,通过协同激活效应 T 细胞反应,从而实现更优的肿瘤控制。(转化医学网360zhyx.com)
参考资料:
https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202500806
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
责任声明:本稿件如有错误之处,敬请联系转化医学网客服进行修改事宜!
微信号:zhuanhuayixue
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发