铁死亡新发现!华中科技大学附属同济医院罗学来教授团队发现治疗肿瘤铁死亡潜在策略
| 导读 | 铁依赖性脂质过氧化物积累引起的铁死亡(Ferroptosis)是一种新兴的调控性细胞死亡形式,被视为癌症治疗的潜在靶点。 |
近日,华中科技大学附属同济医院罗学来教授团队在期刊《ADVANCED SCIENCE》上在线发表题为“Inhibition of CARM1-Mediated Methylation of ACSL4 Promotes Ferroptosis in Colorectal Cancer”的研究论文,在本研究中,研究人员证明CARM1与ACSL4直接相互作用,并通过增加ACSL4的甲基化水平来抑制铁死亡。此外,研究人员还展示了ACSL4的R339甲基化对其蛋白稳定性和与RNF25的相互作用至关重要,这解释了CARM1诱导的抑制铁死亡效应的机制。因此,针对CARM1可能是治疗肿瘤铁死亡的潜在策略。研究结果为铁死亡及其相关药物的新临床治疗靶点开发提供了新的思路和方向。

https://onlinelibrary.wiley.com/doi/10.1002/advs.202303484
研究背景
01
铁死亡(Ferroptosis)是一种遗传编码的程序性细胞死亡形式,其特点是细胞代谢异常和铁依赖性脂质过氧化物的积累。它与经典的细胞死亡过程,包括凋亡、坏死和焦亡等有所不同。越来越多的证据表明,铁死亡与各种病理情况和人类疾病相关,如组织损伤、炎症、神经退行性疾病和癌症等。铁死亡通过多种机制参与肿瘤抑制。最近的研究报道显示,铁死亡可能增强免疫治疗在癌症中的抗肿瘤效果。因此,对肿瘤铁死亡机制及其调控进行深入研究至关重要,并可能在指导临床靶向治疗方面发挥相当大的作用。
脂质过氧化物的积累是铁死亡的一个重要特征,并且其生成和清除会调控脂质过氧化物的积累。长链脂肪酸-CoA连接酶(ACSLs)是在脂肪酸代谢中被广泛研究的重要酶。对铁死亡机制的研究提供了证据表明,ACSL4对铁死亡敏感性起到了至关重要的作用。尽管已经确认了ACSL4在促进铁死亡中的作用,但其上游调控因子尚未明确定义。
非组蛋白蛋白质的翻译后修饰(PTMs),比如磷酸化、甲基化、乙酰化和泛素化,据报道会影响蛋白质的稳定性、功能和相互作用。作为一种普遍存在的PTM,蛋白精氨酸甲基化由精氨酸甲基转移酶(PRMTs)催化。CARM1(也称为PRMT4)催化了不对称二甲基精氨酸(me2a)的形成,并通过多种途径促进肿瘤的进展。在乳腺癌和前列腺癌中,CARM1作为雌激素α和雄激素受体的转录共激活因子。它还可以直接甲基化PKM2并激活有氧糖酵解,从而促进乳腺癌的发展。针对CARM1可以增加耐药肿瘤对免疫疗法的敏感性,并增强抗肿瘤T细胞的功能。然而,CARM1在铁死亡中的作用尚不清楚。
研究发现
02
本研究定义了Ferroptosis的独特作用。抑制CARM1可以增加肿瘤细胞对Ferroptosis诱导剂的敏感性,在体外和体内均有表现。机制上,发现ACSL4在精氨酸339位点(R339)被CARM1甲基化。此外,ACSL4 R339甲基化促进了RNF25与ACSL4的结合,进而促使ACSL4的泛素化。阻断CARM1促进Ferroptosis并有效增强与Ferroptosis相关的肿瘤免疫疗法。该研究证明CARM1是Ferroptosis抵抗的重要因素,并将CARM1作为一个候选的治疗靶点,以提高基于Ferroptosis的抗肿瘤疗法的效果。
CARM1与结直肠癌的铁死亡呈负相关
03
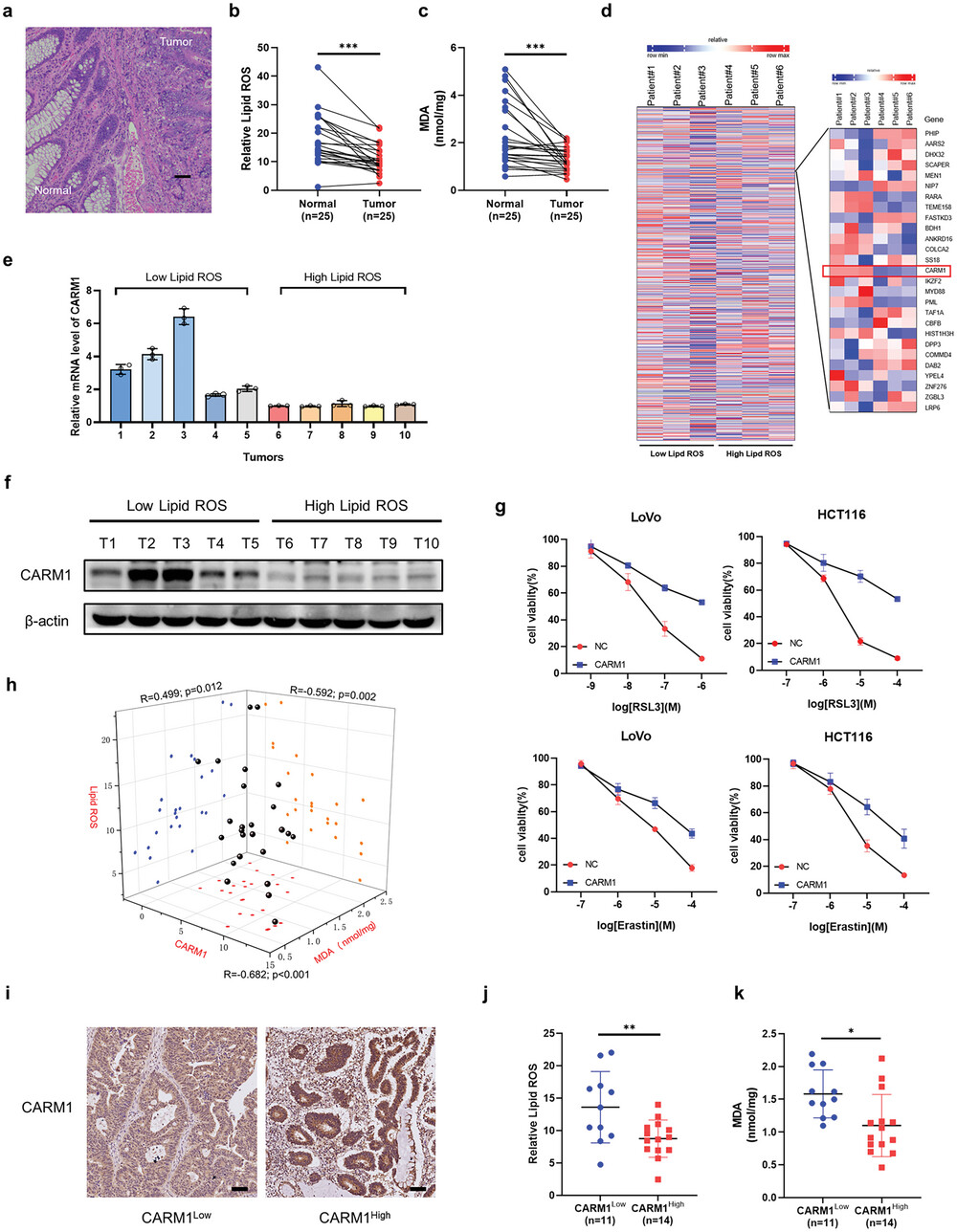
为了评估铁死亡与结直肠癌(CRC)进展之间的潜在相关性,研究人员收集了25对CRC和癌旁组织,并测量了脂质过氧化(脂质ROS)和丙二醛(MDA)水平,以评估这些组织在接受铁死亡诱导剂RSL3处理后的铁死亡水平。结果显示,癌组织中的铁死亡相对于癌旁组织来说较弱。为了筛选调节铁死亡的关键因子,研究人员对具有高脂质ROS水平和低脂质ROS水平的六位患者的肿瘤进行了RNA测序;在低脂质ROS组中有461个基因上调,而680个基因下调。在这些基因中,研究人员着重关注了甲基转移酶,最近有报道称其参与肿瘤进展。
RNA测序数据显示,在低脂质ROS组中,CARM1上调表达,而PRDM8和PRDM13下调表达。然而,与CARM1相比,在肠道中PRDM8和PRDM13的表达可以忽略不计。因此,研究人员首先验证了CRC组织中CARM1的表达。对来自高脂质ROS组和低脂质ROS组的10个肿瘤进行了定量实时PCR(qPCR)和免疫印迹分析,检测CARM1在mRNA和蛋白水平的表达情况,结果显示随着脂质ROS水平的增加,CARM1的表达逐渐降低。
为了进一步验证CARM1与铁死亡的关系,研究人员使用CCK-8试剂盒进行了细胞活力实验,发现CARM1过表达可以逆转RSL3和erastin引发的铁死亡效应。此外,研究人员根据CARM1的免疫组化评分确定了CARM1表达水平,并发现CARM1的表达与患者CRC肿瘤组织中的脂质ROS和MDA水平呈显著负相关。
与CARM1被认为是癌症进展的促进因子一致,免疫组化染色(IHC)和免疫印迹结果也显示CARM1在CRC组织中上调表达。随后,对TCGA-COAD和GSE20916数据集中公开可获得的CRC表达谱进行了分析,发现CARM1在原发性肿瘤和腺癌中均上调表达。随后,利用含有78个恶性结肠肿瘤临床标本的组织芯片进行了IHC染色来评估生存曲线,发现CARM1水平高的患者表现出明显较短的总生存期。这些数据表明CARM1与结直肠细胞的铁死亡呈负相关。
研究结果
04
综上所述,在本研究中,研究人员证明CARM1与ACSL4直接相互作用,并通过增加ACSL4的甲基化水平来抑制铁死亡。此外,研究人员还展示了ACSL4的R339甲基化对其蛋白稳定性和与RNF25的相互作用至关重要,这解释了CARM1诱导的抑制铁死亡效应的机制。因此,针对CARM1可能是治疗肿瘤铁死亡的潜在策略。研究结果为铁死亡及其相关药物的新临床治疗靶点开发提供了新的思路和方向。(转化医学网360zhyx.com)
参考资料:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202303484
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发