医校大联动!中外团队合作最新研究揭秘调节“癌王”——胰腺癌的致癌基因
| 导读 | 胰腺导管腺癌 (PDAC) 肿瘤携带多种基因突变,对治疗反应不佳。目前,对能够递送多种基因货物以靶向PDAC等高实体瘤负荷的药物载体的需求尚未得到满足。 |
近日,深圳湾实验室肿瘤研究所/北京大学深圳研究生院 Andrew Lee 教授联合俄亥俄州立大学、思珀生物、台湾阳明交通大学、台湾成功大学医院和德克萨斯大学安德森癌症中心的研究人员,在《Nature Communications》 期刊发表了题为“Dual targeted extracellular vesicles regulate oncogenic genes in advanced pancreatic cancer”的研究论文。研究报道了一种携带高载量治疗性RNA的双靶向细胞外囊泡(dtEV),可有效抑制小鼠中的大PDAC肿瘤。EV 表面含有一种 CD64 蛋白,该蛋白具有组织靶向肽和人源化单克隆抗体。通过基于 Transwell® 的不对称细胞电穿孔,用编码目标 RNA 和蛋白质的质粒 DNA 顺序转染细胞,释放具有高 RNA 负载量的大量靶向 EV。dtEVs 与低剂量化疗药物吉西他滨一起抑制小鼠的大原位 PANC-1 和患者来源的异种移植肿瘤和转移,并延长动物存活时间。我们的工作提出了一种临床上可及且可扩展的方法,可以生产丰富的 EV,用于将多个基因递送至大型实体瘤。

https://www.nature.com/articles/s41467-023-42402-3
研究背景
01
胰腺导管腺癌(PDAC)难以治疗,5 年生存率较低,仅为 <10%。 GTPase KRAS突变发生在>90%的PDAC中,唯一针对RAS家族的临床可用药物是非小细胞肺癌(LUMAKRAS,sotorasib™)中KRASG12C突变抑制剂。大多数患者在诊断时患有携带多种基因突变的晚期不可切除肿瘤。在这些病例中,70% 的 KRASG12D 突变与突变的 TP53 抑癌基因同时发生。因此,需要针对PDAC中多个突变的新疗法。然而,将多种基因因子精确地递送至这种晚期肿瘤是一项重大挑战。脂质体纳米颗粒(LNP)虽然很受欢迎,但不适合实体瘤治疗,因为它们不能很好地穿透组织或穿越生理屏障,而病毒可以有效递送,但具有高度免疫原性。
外泌体和微囊泡等细胞外载体(EV)是基因递送的有吸引力的替代品,因为它们具有低免疫原性和细胞毒性,并且可以穿过生理屏障。含有外源性沉默 RNA 的外泌体用于KRASG12D (siKRASG12D) 已被证明可以抑制小鼠模型中的小的、非晚期的、原位 PANC-1 PDAC 肿瘤。我们之前还使用携带内源性磷酸酶和张力蛋白同源物 (PTEN) mRNA 的 EV 来减缓胶质母细胞瘤小鼠中小肿瘤的生长。虽然前景广阔,但要使这些基于EV的疗法具有临床相关性,它们必须能够携带多种基因货物,精确靶向、穿透和治疗大型实体PDAC肿瘤和转移瘤。此外, 产生的EV 的必须具有可扩展性和随时可用性。目前的方法包括将合成的RNA插入预先分离的EVs中,这很难装载大型mRNA,或者对供体细胞进行基因修饰,这很复杂,并且面临脱靶基因组整合的风险。
研究结果
02
在这项工作中,我们报道了易于扩展的双靶向治疗性 EV (dtEV),其中包含高拷贝数的 TP53 mRNA 或 siKRASG12D,可以抑制大型实体 PDAC 肿瘤(图 1a)。我们的 dtEV 表面含有一种 CD64(Fc-γ 受体 1)蛋白,该蛋白在 N 末端与靶向胰腺肿瘤组织的 CKAAKNK (CK) 组织归巢肽进行工程改造。这种工程蛋白(CD64CK) 充当通用锚,以高亲和力与任何临床可用的治疗性人源化单克隆抗体(hmAb)结合,在 EV 表面形成第二个靶向配体。我们使用人源化抗受体酪氨酸激酶样孤儿受体 1(αROR1,克隆:2A2)抗体作为靶向肿瘤上常见但非正常组织上常见的 ROR1 受体的第二配体。通过基于Transwell的不对称细胞电穿孔(TACE)将产生CD64CK蛋白和TP53 mRNA或siKRASG12D的质粒DNA依次递送至小鼠胚胎成纤维细胞(MEF)或人骨髓干细胞(hBMSC)中,这是一种使用经济实惠的Transwell®®插入物的临床可及性和可扩展的方法。通过TACE依次递送CD64CK质粒DNA和TP53或siKRASG12D质粒DNA,促进EV内高TP53 mRNA和EV表面CD64CK蛋白的丰富EV的释放。在与人源化αROR1抗体亲和结合后,我们的dtEV与一线化疗药物吉西他滨(GEM)一起抑制小鼠的大型原位PANC-1和患者来源的异种移植物(PDX)肿瘤和转移,并通过强大的基因调控、癌细胞周期阻滞和降低化疗耐药性来延长动物存活期。我们的细胞运输结果表明,双重靶向促进受体介导的组织渗透、肿瘤细胞摄取和 EV 胞质溶胶 RNA 释放。我们的工作展示了一种简单、低成本的方法来生产携带大量基因货物的靶向EV,这些EV可以有效地治疗动物模型中的晚期癌症。
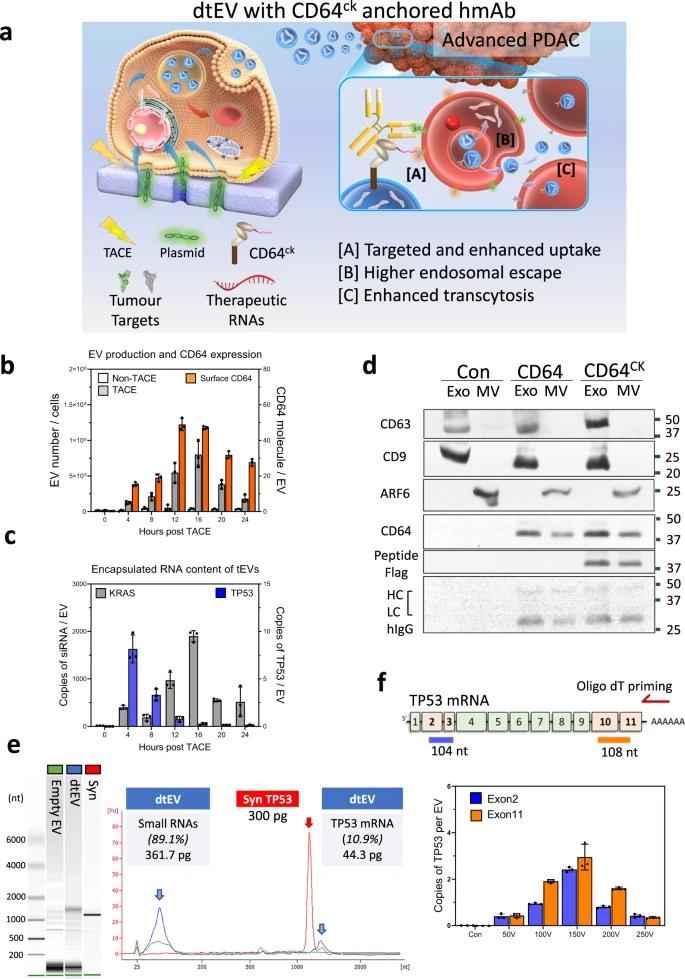
dtEVs的产生和表征。
研究意义
03
总之,本研究将使设计最佳的dtEV基因制剂和化疗药物组合成为可能,为个体癌症患者量身定制,并具有适当的剂量。鉴于肿瘤内癌细胞的异质性以及治疗过程中可能出现更多突变的可能性,有必要及时调整dtEV基因的配方和剂量。除了传统的化疗药物外,我们基于EV的基因疗法还具有与其他癌症治疗方式相结合的潜力。此外,通过TACE产生的靶向EV可用于从不同的细胞来源递送特定的编码和非编码基因,在神经退行性疾病、自身免疫性疾病、传染病和罕见疾病等各种疾病中具有潜在的应用。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41467-023-42402-3
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发