【Cancer Cell】芝加哥大学何川携手中科院罗成等发现可增强放疗抗肿瘤疗效的新机制
| 导读 | RNA N6-甲基腺苷(m6A)修饰与癌症的进展有关。然而,m6A对放疗抗肿瘤作用的影响及其相关机制尚不清楚。 |
高达60%的癌症患者接受放射治疗,但并非全部有效。治疗失败的原因或是由于原发肿瘤部位的肿瘤再生,或是肿瘤转移到身体的另一部分。5月25日,芝加哥大学 Ralph Weichselbaum 教授、何川教授、Hua Laura Liang 教授与中国科学院上海药物研究所罗成研究员等在《Cancer Cell》发表了题为:“YTHDF2 inhibition potentiates radiotherapy anti-tumor efficacy”的研究论文。研究发现,YTHDF2可作为放疗和放疗/免疫联合疗法的潜在靶点,提出了通过抑制YTHDF2来增强临床放射治疗效果的新策略。

https://www.cell.com/cancer-cell/fulltext/S1535-6108(23)00163-0
远排 vs “坏斯科帕尔(bad-scopal)”
放射治疗有时会产生所谓的远隔效应,其中肿瘤的局部辐射也会导致身体另一部分的肿瘤缩小。这种现象很少见,但被认为涉及免疫系统的激活。辐射刺激积极的免疫作用,例如产生更多的抗原呈递细胞和CD8 T细胞,以及抑制抗肿瘤免疫反应的负面影响。一种称为髓源性抑制细胞(MDSC)的血细胞迁移到肿瘤部位,并通过阻断CD8 T细胞抗肿瘤作用来抑制抗肿瘤免疫反应。MDSC的涌入也干扰了免疫疗法,免疫疗法旨在释放免疫系统来对抗肿瘤。
研究人员观察到,在辐射之后,当患者的MDSC水平上升时,他们会产生不良后果。MDSC在放疗后也过度表达Y2。遗传学和表观遗传学分析表明,Y2诱导激活了MDSCs在肿瘤以及整个身体中的迁移和免疫抑制功能。令人惊讶的是,这种局部治疗对整个身体都有影响。
在许多情况下,这些丰富的Y2表达细胞似乎也在局部辐射后进行远处转移,Weichselbaum将这一效应称为“坏斯科帕尔”效应,并表示这种效应被低估了,但它似乎比远隔效应更常见。
研究进展
为了进一步证明YTHDF2是潜在的改善放疗和RT/免疫联合疗法的靶点,研究人员通过靶向YTHDF2开展化学干预研究。基于建立的化合物高通量筛选方法,开展了小分子抑制剂的筛选并获得了YTHDF2的活性化合物DC-Y13。通过结构改造获得了化合物DC-Y13-27,其可以在体外直接结YTHDF2蛋白并抑制其与m6A-RNA的结合。此外,DC-Y13-27在小鼠上与敲除YTHDF2类似,不仅可有效提高的IR疗效,而且提高了IR与PD-L1抗体联合治疗的抗肿瘤效果。抑制YTHDF2克服了MDSC诱导的免疫抑制,不仅可以改善局部肿瘤治疗效果,还可以抑制肿瘤转移。
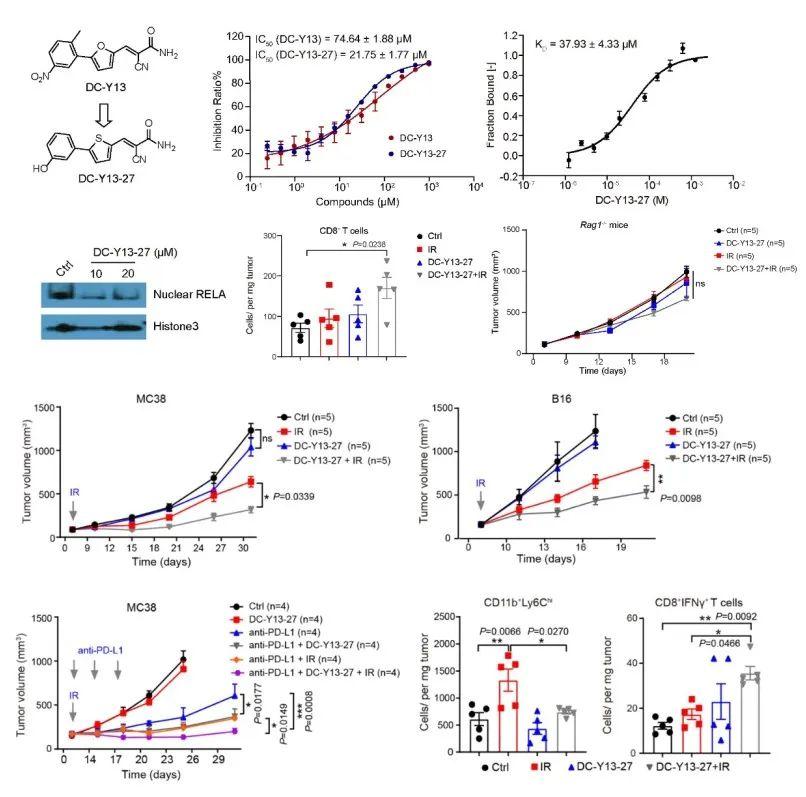
YTHDF2抑制剂DC-Y13-27的发现及其对放疗和免疫治疗疗效的提高作用
研究结果
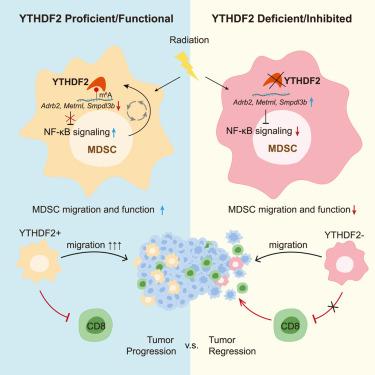
综上,研究人员发现电离辐射(IR)诱导免疫抑制骨髓源性抑制细胞(MDSC)的扩增和YTHDF2的表达。IR后,髓系细胞中Ythdf2的缺失通过改变MDSC分化,抑制MDSC浸润和抑制功能,增强抗肿瘤免疫,克服肿瘤放射耐药。Ythdf2缺失逆转了局部IR对MDSC种群景观的重塑。IR诱导的YTHDF2表达依赖于NF-κB信号通路;YTHDF2通过直接结合和降解编码NF-κB信号通路负调控因子的转录本,导致NF-κB激活,从而形成IR-YTHDF2-NF-κB回路。YTHDF2的药理抑制克服了MDSC诱导的免疫抑制,并改善了IR和/或抗pd-l1联合治疗。因此,YTHDF2是改善放疗(RT)和RT/免疫治疗组合的一个很有前途的靶点(转化医学网360zhyx.com)。
参考资料:
https://medicalxpress.com/news/2023-05-blocking-key-immune-protein-therapy.html
https://www.cell.com/cancer-cell/fulltext/S1535-6108(23)00163-0
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发