【ADV SCI】南京大学等合作开发新型纳米平台,实现恶性肿瘤低氧微环境光动力/化疗协同治疗
| 导读 | 缺氧条件下的光动力疗法(PDT)和化疗中的耐药性是抗肿瘤治疗的关键难题。如何克服肿瘤微环境中低氧的不利条件,使得在PDT治疗期间顺利产生细胞毒性单线态氧,进而杀死肿瘤细胞,已成为一个重要课题。 |
近日,来自南京大学、南京医科大学和郑州大学的研究者设计了一种新型多功能蛋白质杂交纳米平台(ODP-TH),在肿瘤缺氧区域实现了氧转运和蛋白质同源性识别,实现了对乳腺癌、胶质瘤等多种肿瘤的有效治疗。
其研究成果于12月21日发表于 Advanced Science 期刊。

https://onlinelibrary.wiley.com/doi/10.1002/advs.202203742
肿瘤微环境(TME)低氧
01
肿瘤微环境(TME)具有许多与正常生理条件不同的物理和化学特性,如低氧、低pH值、高浓度间质液和高血管通透性。在这些特征中,缺氧环境与肿瘤生长、转移和预后不良密切相关。内部血管不受控制的增殖和异常发育导致了肿瘤代谢亢进。肿瘤细胞的高代谢耗尽了内部的氧气;这反过来又使这些细胞产生耐氧效果,进一步增强了肿瘤的恶性程度。
近年来,光动力疗法(PDT)因其低毒性、非侵入性及免疫激活等优势而被广泛研究——结合激光照射病变内部光敏剂,PDT通过产生细胞毒性单线态氧来杀死肿瘤细胞。然而,肿瘤微环境(TME)的低氧特性限制了PDT期间细胞毒性单线态氧的产生;更为糟糕的是,PDT进一步耗尽了TME中存在的少量氧气,进而导致治疗进入恶性循环状态。
鉴于缺氧环境阻碍了传统治疗的有效性,人们越来越关注设计新方法来改善肿瘤缺氧微环境——例如过氧化氢纳米载体,肿瘤中的类芬顿样(Fenton-like)反应,二氧化锰纳米系统和高压氧疗法等,通过外部或内部携氧来解决缺氧问题。
血红蛋白(Hb)是一种包裹在红细胞中的蛋白质,广泛存在于脊椎动物中。一个Hb分子最多可携带四个氧分子,并在缺氧区域释放,可用于解决组织供氧问题。基于其氧运输能力和生物安全性,Hb在新型生物医学纳米平台开发中具有广阔的前景。然而,虽然Hb具有良好的氧气运输能力,但人体内有许多缺氧组织,如何将纳米颗粒精确转运到缺氧TME中已成为了一个新兴的课题。
药物穿越血脑屏障
02
血脑屏障(BBB)是一种生理屏障,主要由胶质细胞和毛细血管组成,能够将脑组织与其他组织分隔开。很少有脂溶性药物可以通过自由扩散穿过BBB,因此手术是当前治疗颅内肿瘤(如神经胶质瘤)的主要方法。然而,大多数手术治疗都是基于功能保护的原则,无法实现肿瘤全切除。因此,术后辅助脑给药对于肿瘤治疗至关重要。目前,越来越多的纳米平台正在被开发用于靶向大脑的药物递送,在这些纳米平台的开发中,以受体介导的转运(RMT)作为穿越血脑屏障(BBB)的机制,被认为具有较好的应用前景。
RMT在药物递送纳米平台开发中的应用是一个研究热点。TRF是一种铁载体蛋白,广泛存在于人体血液中。TRF可以识别并结合细胞膜表面的转铁蛋白受体(TFRs),通过血液循环完成细胞中的铁转运。与正常细胞膜相比,肿瘤和脑毛细血管内皮细胞膜含有显着更高的TFRs量,这为识别并与TRF结合提供了更大的可能性。利用这一特性,基于TRF和TFR同源识别的靶向BBB的肿瘤药物递送纳米平台非常有前途。
新型多功能蛋白质杂交纳米平台(ODP-TH)
03
受上述研究基础的启发且考虑到联合治疗的必要性,此次研究创新性地开发了一种新型多功能蛋白质杂交纳米平台(ODP-TH)。ODP-TH由作为多类实体瘤识别因子的转铁蛋白(TFR)和供氧的血红蛋白组成。基于谷胱甘肽响应的二硫键交联,该蛋白质杂交框架封装了光敏剂原卟啉IX(PpIX)和化疗药阿霉素(Dox)。
从机制上讲,ODP-TH穿过血脑屏障(BBB),通过蛋白质同源性识别在缺氧肿瘤中特异性聚集。氧气和包封药物通过下调多重耐药基因1(MDR1)和缺氧诱导因子-1-α(HIF-1α)的丰度来促进治疗效果。具体来说,通过将光敏剂PpIX和化疗药物Dox封装在杂化蛋白壳(ODP-TH)中形成多功能纳米平台(请见图1)。
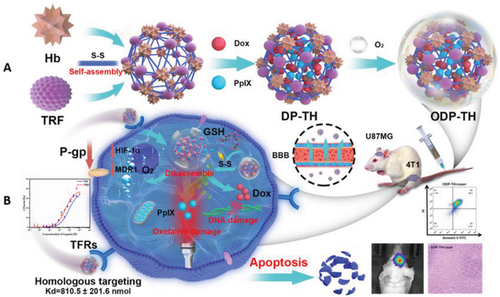
图1:ODP-TH合成和细胞内作用机制
结果表明,ODP-TH在肿瘤缺氧区域实现了氧转运和蛋白质同源性识别。由于其优异的同源蛋白识别能力,ODP-TH能够成功穿过BBB并被不同类型的癌细胞准确快速地吸收。此后,存在于纳米壳中的HbO2在低氧TME中自发并持续地解离O2,缓解了肿瘤中的顽固性低氧。
研究意义
04
该多功能蛋白质杂交纳米平台(ODP-TH)结合了肿瘤靶向聚集和协同治疗效果,其纳米复合材料比单体血红蛋白(Hb)具有更好的携氧能力,能够轻松携带氧气并将氧气自动释放到肿瘤深处的缺氧部位,显著缓解TME的缺氧特性。
此外,TRF和TFR的同源相互作用比NPs更精确地靶向ODP-TH,NPs仅依赖于对靶肿瘤的EPR效应。此外,药物分布研究表明,包封在ODP-TH中的PpIX和Dox在注射后48 h肿瘤部位丰富,这归因于ODP-TH的直径较小且具有同源靶向功能。值得注意的是,在ODP-TH充足氧气的支持下,该研究的策略为PDT提供了必要的材料,并显著缓解了化疗中的耐药性问题。体内外和体外的抗肿瘤实验表明,ODP-TH的抗肿瘤作用先于PDT联合化疗。因此,这种多功能纳米平台提供了一种密集的方法,在癌症治疗方面具有广阔的应用前景。(转化医学网360zhyx.com)
参考资料:
https://onlinelibrary.wiley.com/doi/10.1002/advs.202203742
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发