STTT | 中国医学科学院肿瘤医院冉宇靓教授等揭示胃癌代谢新机制,二甲双胍联合用药展现强效抗肿瘤效果
| 导读 | 代谢靶向治疗联合传统信号通路抑制剂,或将成为精准肿瘤学的重要发展方向。 |
近日,中国医学科学院肿瘤医院冉宇靓教授等发表在国际顶级期刊《信号转导与靶向治疗》(Signal Transduction and Targeted Therapy,IF=52.7)的一项开创新研究:首次系统揭示了糖酵解关键酶α-烯醇化酶(ENO1)通过调控细胞内ATP池与乳酸稳态,协同激活PI3K/AKT和AMPK/mTOR信号通路,进而促进胃癌干细胞特性及恶性进展的全新机制,该研究为胃癌的代谢靶向治疗提供了突破性理论依据。
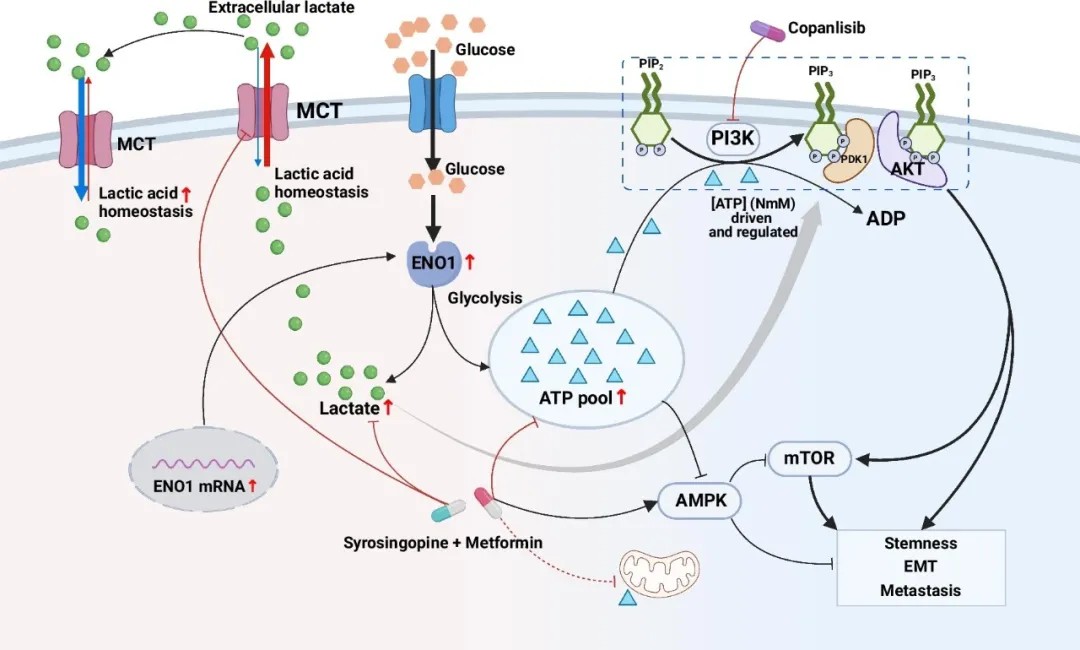
ENO1调控胃癌干性的机制示意图
代谢重编程驱动胃癌干性:ENO1为核心枢纽
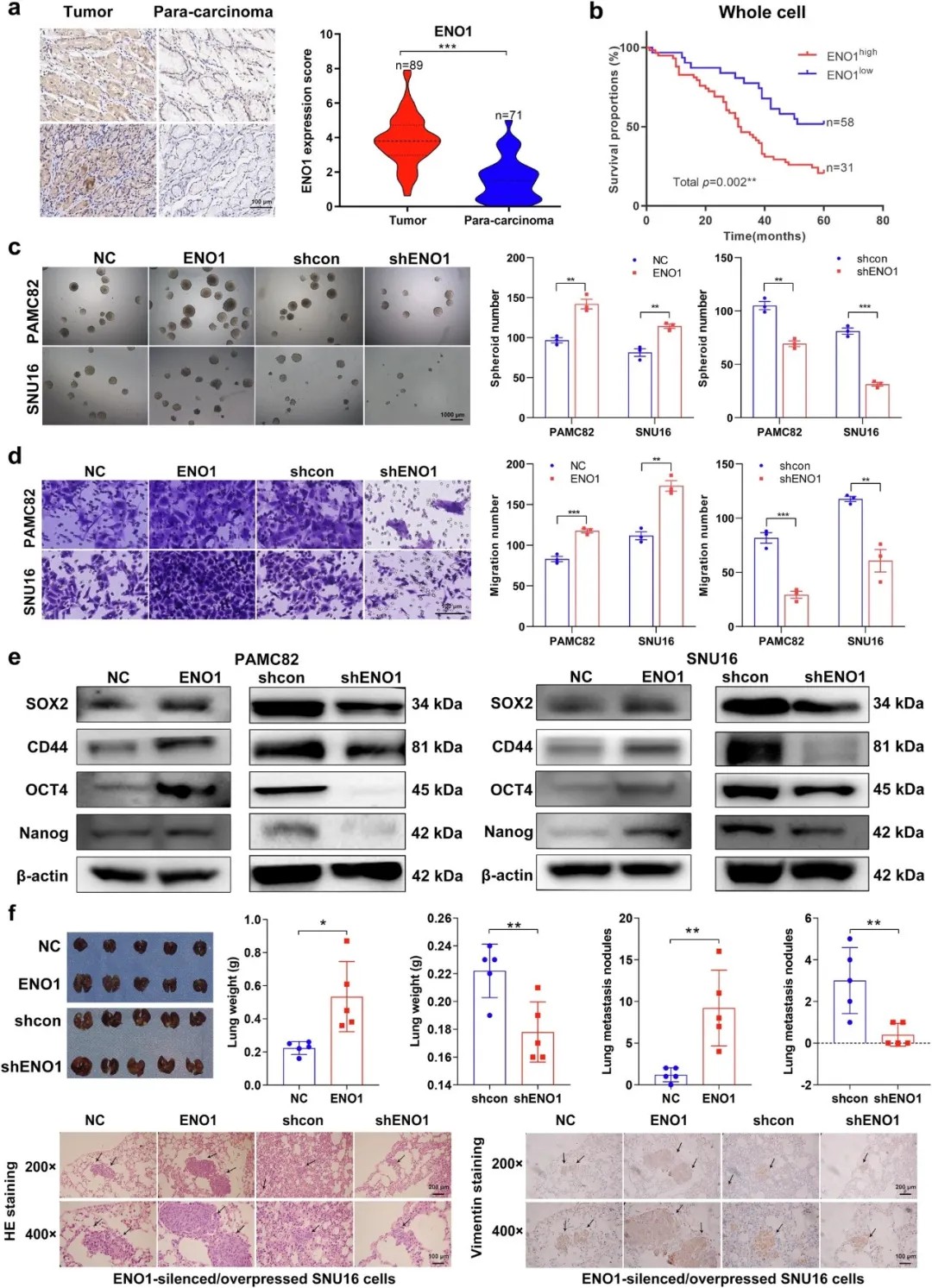
ENO1高表达与胃癌患者不良预后及干细胞样特性相关
研究团队通过组织芯片及免疫组化分析发现,ENO1在胃癌组织中表达显著上调,且高表达与患者不良预后密切相关。功能实验表明,ENO1过表达可显著增强胃癌细胞的成球、迁移、侵袭能力及干细胞标志物表达,而敲低ENO1则逆转上述表型。进一步的动物实验证实,ENO1高表达显著促进肺癌转移,提示其作为胃癌恶性进展的关键驱动因子。
双通路协同调控机制:ATP与乳酸扮演信号分子
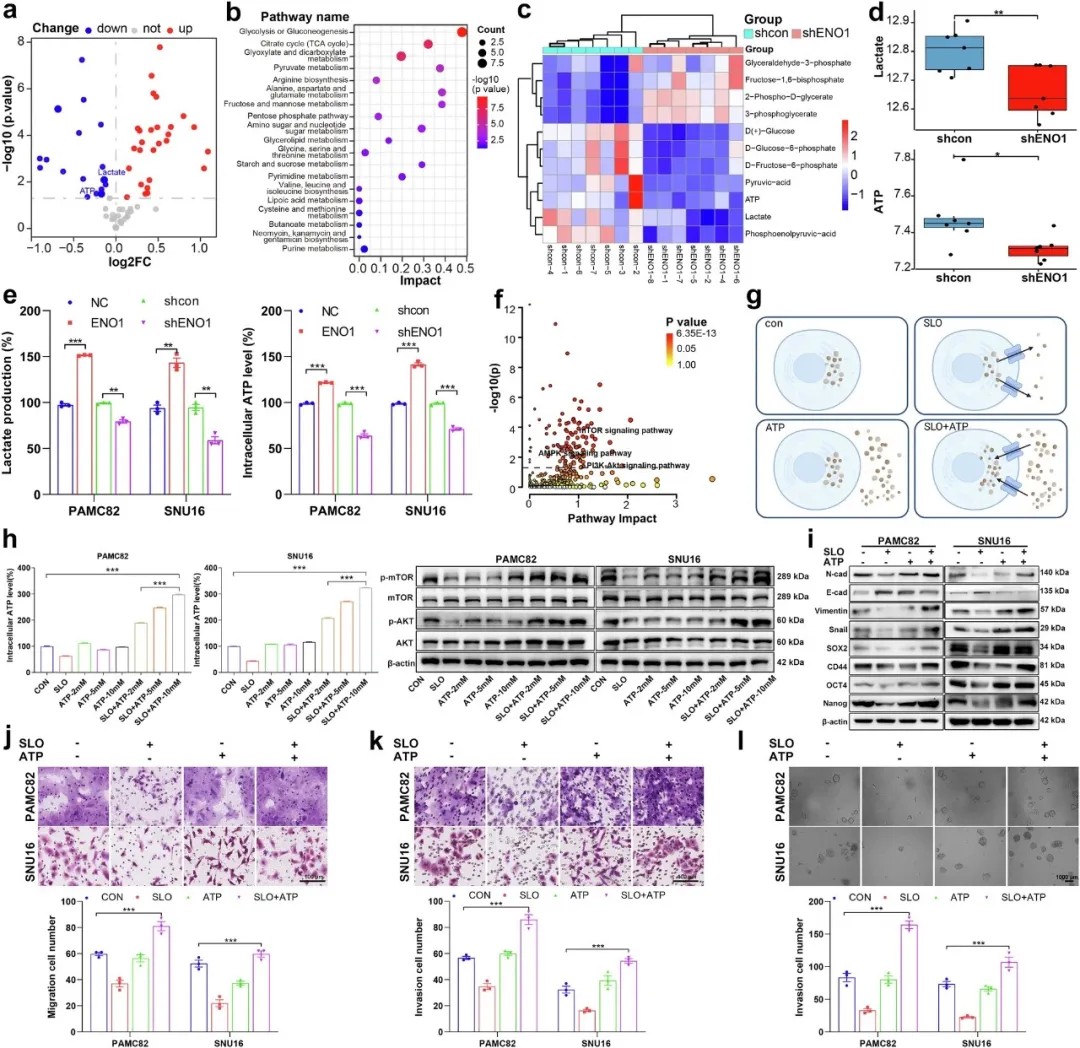
ENO1通过调控PI3K/AKT和AMPK/mTOR通路促进干细胞样特性
研究首次提出“代谢物-信号通路”双向调控模型:ENO1通过增强糖酵解,提升细胞内ATP和乳酸水平。其中,胞内ATP池可直接浓度依赖性地激活PI3K/AKT通路,形成“糖酵解-ATP-PI3K/AKT”正反馈循环;而乳酸则通过调节全局乳酸化水平及依赖糖酵解来源的ATP协同激活PI3K/AKT通路,共同促进上皮-间质转化和肿瘤干性。值得注意的是,乳酸的功能发挥需以糖酵解来源的ATP为前提,揭示二者在代谢信号传导中的协同作用。
ENO1通过调节乳酸和ATP的产生以激活PI3K/AKT通路,进而促进肿瘤侵袭和干性
靶向治疗新策略:双药联用显协同效应
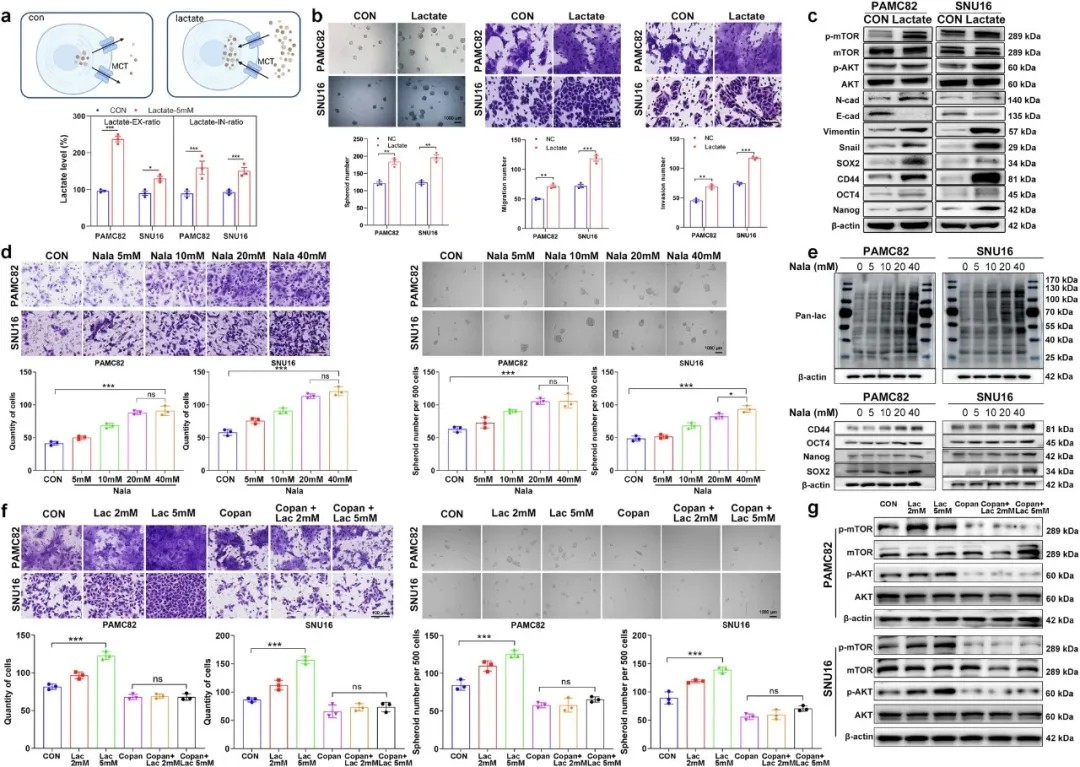
乳酸以剂量依赖性方式促进肿瘤侵袭和干性,该过程由糖酵解来源的ATP依赖性PI3K/AKT激活所介导
基于上述机制,研究团队探索了靶向代谢通路的联合治疗策略。体外及体内实验表明,临床常用药物二甲双胍(AMPK激活剂)联合PI3K抑制剂科帕利西布可显著抑制肿瘤细胞活力、成球及转移能力。更令人振奋的是,二甲双胍与乳酸转运体抑制剂Syrosingopine联用,通过同步靶向ATP合成与乳酸外排,协同抑制PI3K/AKT通路并激活AMPK/mTOR通路,在小鼠移植瘤模型中表现出强效抗肿瘤效果,且毒性可控。
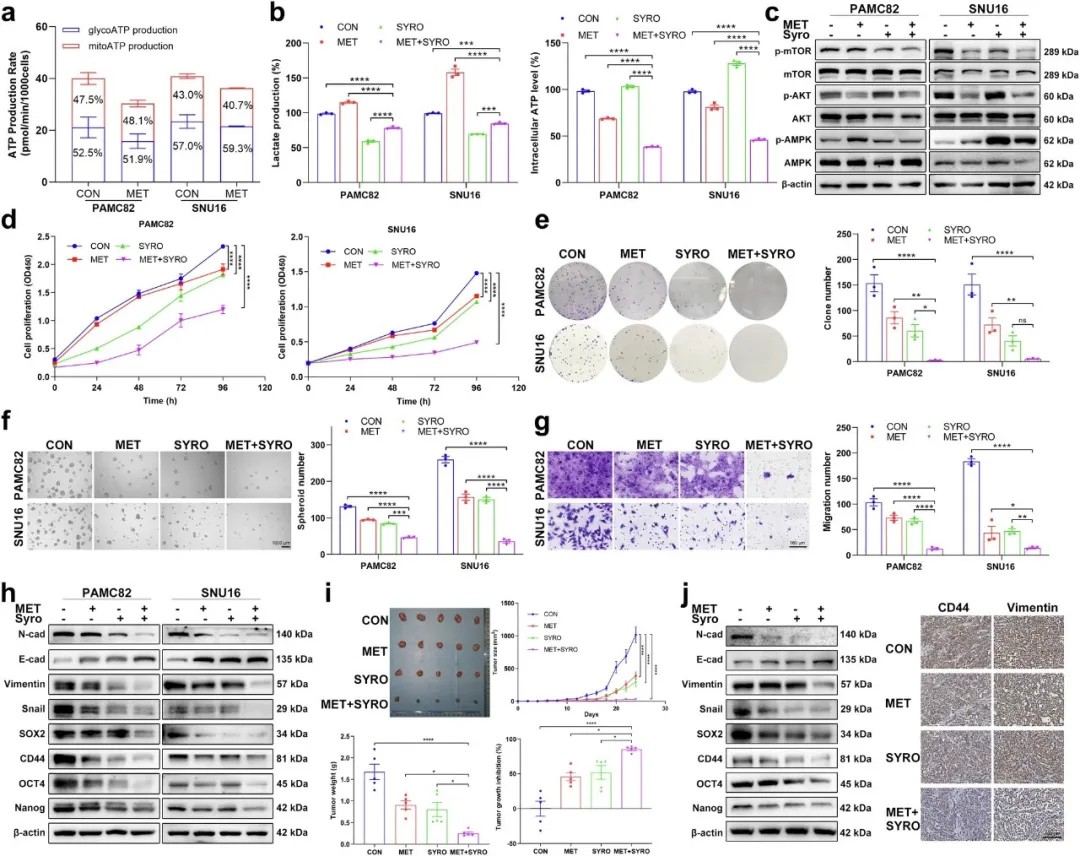
同时靶向ATP和乳酸可抑制胃癌细胞的干性及肿瘤生长
临床转化与未来展望
该研究不仅阐明了ENO1在胃癌代谢重编程中的核心地位,更开创性地揭示了ATP与乳酸作为信号分子直接调控致癌通路的新机制,为破解胃癌治疗耐药难题提供了全新视角。代谢靶向治疗联合传统信号通路抑制剂,或将成为精准肿瘤学的重要发展方向。(转化医学网360zhyx.com)
原文链接:
https://www.nature.com/articles/s41392-025-02451-0
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
责任声明:本稿件如有错误之处,敬请联系转化医学网客服进行修改事宜!
微信号:zhuanhuayixue
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发