【Cell子刊】中国科学技术大学魏海明团队:揭示p53调节肿瘤免疫微环境的潜在机制
| 导读 | 团队发现癌症干细胞(CSCs)建立了白细胞介素34(IL-34)编排的生态位,以促进p53灭活肝癌的肿瘤发生。 |
2024年9月24日, 中国科学技术大学生命科学学院魏海明团队在期刊《Immunity》上发表了题为“Interleukin-34-orchestrated tumor-associated macrophage reprogramming is required for tumor immune escape driven by p53 inactivation”的研究论文。研究结果揭示了p53调节肿瘤免疫微环境的潜在机制,并为p53失活癌症的免疫治疗提供了潜在的靶点。

https://www.cell.com/immunity/fulltext/S1074-7613(24)00415-1
研究背景
01
免疫检查点抑制剂(ICI)彻底改变了癌症治疗,并改善了临床生存结果。然而,只有少数患者实现了长期、持久的反应,而ICI耐药对大多数患者来说是一种不幸的经历。ICIs的疗效由肿瘤免疫微环境(TIME)决定。肿瘤相关巨噬细胞(TAM)是TIME最丰富的免疫群体,具有很强的免疫抑制能力。
TP53(编码p53蛋白)是人类癌症中最常见的突变基因。p53因其在诱导应激细胞周期停滞和细胞凋亡中的作用而被称为“基因组守护者”。在小鼠模型中,p53的再激活被证明是一种有效无误的癌症疗法,可导致许多不同类型肿瘤的消退。
癌症干细胞(CSCs)产生表型异质性并导致治疗耐药性,但它们在免疫治疗中的作用知之甚少。在这项研究中,团队发现p53直接调节IL-34的表达。研究结果揭示了将p53失活与IL-34信号激活联系起来的分子机制,并表明阻断IL-34信号是携带p53突变的肿瘤患者的潜在免疫疗法。
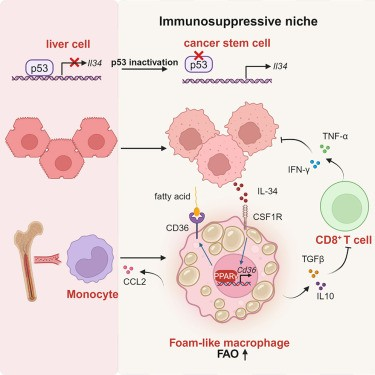
图形摘要
研究进展
02
p53功能的缺失直接触发IL-34的分泌
团队发现CT细胞(Trp53)和AML12细胞(小鼠肝细胞系)中Trp53的基因缺失,导致在用Nutlin-3预处理细胞后,无法增加p21表达。Trp53的基因缺失,导致IL-34的表达上调。相比之下,在PT细胞中过表达Trp53时,Il34转录受到显著抑制(Trp53+/+−/−)。
团队在IL34和CDKN1A(p21)基因座观察到p53结合。ChIP-PCR和DNA下拉分析,还显示p53与IL34启动子结合。这些结果表明,p53直接抑制IL34转录。
与空载体相比,p53过表达,导致标准化荧光素酶活性降低。当与突变体p53(R249S或R175H)共转染时,未观察到这些降低。当-1,200至-800区域缺失时,p53的调节活性丢失。共有p53结合位点(RRRCWWGYYY)34位于IL34启动子的-858至-838处,并突变了该结合位点,消除了WT p53过表达时降低的荧光素酶活性。
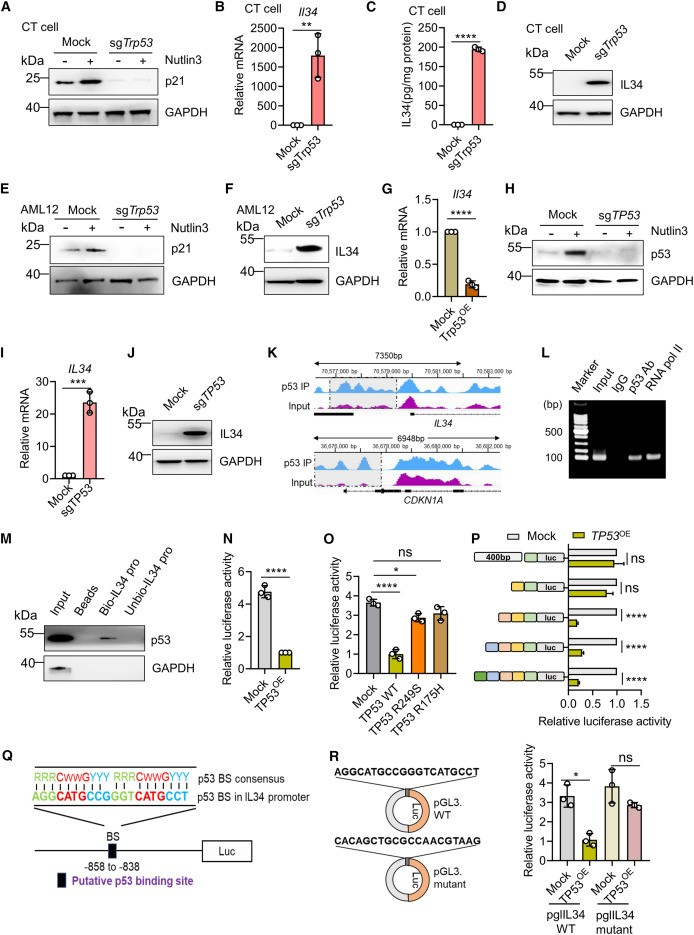
p53功能缺失直接触发IL-34的分泌
阻断IL-34信号可作为TP53突变癌症的潜在免疫疗法
IL-34或CD36的抗体阻断,导致显著的肿瘤生长受限。单核细胞和TAM的比例显著降低,脂质含量、TAM的脂质含量和CD206表达降低,抗体阻断IL-34或CD36。此外,阻断IL-34或CD36,导致T细胞浸润和产生IFN-γ和TNF-α的百分比显著增加。用抗IL-34和抗CD36的组合治疗的PT荷瘤小鼠,引起了更强的生长限制,并显著延长了小鼠的存活时间。这些数据表明,IL-34-CD36轴是p53失活肝癌的潜在治疗靶点。
皮下和肝脏接种的Trp53−/−PT肿瘤对抗PD-1治疗,没有反应。然而,Il34的基因缺失与抗PD-1联合强烈协同抑制肿瘤生长,导致高达75%的病例(皮下接种:9/10;肝脏接种:7/9)出现完全反应。由抗IL-34、抗CD36和抗PD-1组成的联合治疗,完全阻断了Trp53−/−肿瘤发展,甚至在已建立的较大肿瘤中,引起强烈的生长限制。
47TP53突变肝癌中IL34的表达,高于TP53 WT。此外,IL-34在具有TP53突变的人肝癌中上调,而IL-34在具有TP53 WT的肝癌中不表达。IL34表达较高的肝癌患者,总生存期较差。来自TCGA 数据库的其他癌症,包括膀胱尿路上皮癌(BLCA)、结肠腺癌(COAD)、乳腺癌浸润性癌(BRCA)、子宫癌肉瘤(UCS)的分析表明,与TP53 WT相比,IL-34在TP53突变状态中也上调。
TP53突变的肝癌比TP53 WT的肝癌,具有更大的巨噬细胞浸润范围。IL34表达与巨噬细胞的浸润丰度,呈正相关。IL34表达与CD36、TGFB1和CCL2的表达,呈正相关。肿瘤细胞高表达IL34和TAMs,表现出CD36的强表达,而它们在所有其他细胞类型中的表达都很弱。与TP53 WT相比,TP53突变的肝癌增加了CD36 TAM浸润。接受ICI治疗的TP53突变癌症患者,总生存期较差。
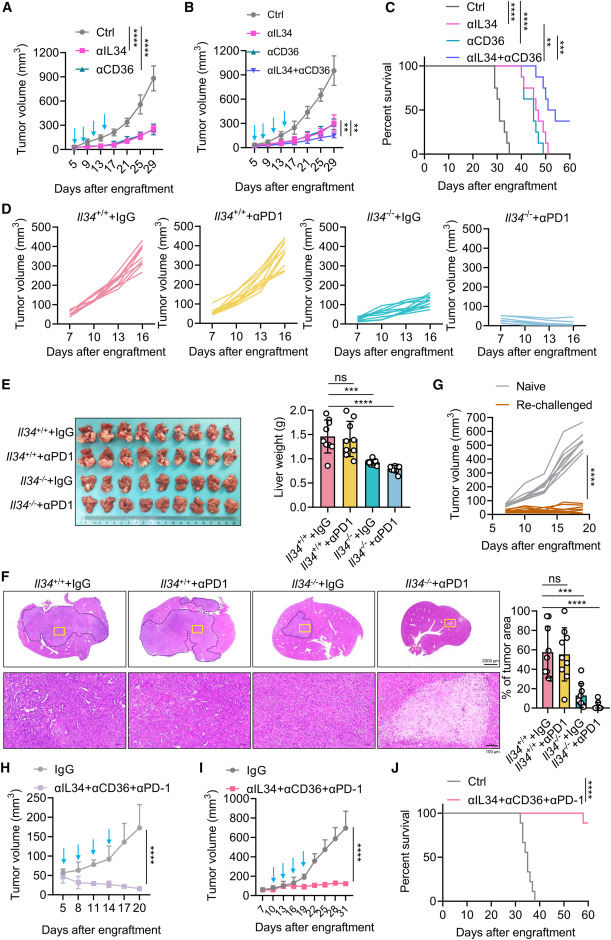
阻断IL-34信号传导抑制肝癌生长,p53失活
研究结论
03
科学界如何发现和瞄准TIME的巨大复杂性和多样性?这是癌症领域需要解决的重大问题之一。未来免疫疗法的临床成功,可能取决于个体化或量身定制的策略。研究结果表明,阻断IL-34信号传导,可能是对携带TP53突变的癌症患者的一种有效的个性化免疫疗法。
参考资料:
1.Sangro, B. ∙ Sarobe, P. ∙ Hervás-Stubbs, S. ...
Advances in immunotherapy for hepatocellular carcinoma
Nat. Rev. Gastroenterol. Hepatol. 2021; 18:525-543
2.Suresh, S. ∙ O’Donnell, K.A.
Translational Control of Immune Evasion in Cancer
Trends Cancer. 2021; 7:580-582
 腾讯登录
腾讯登录



还没有人评论,赶快抢个沙发