南京医科大学王学浩院士团队:肿瘤转移的机制洞察与治疗干预
| 导读 | 本文深入探讨了转移相关基因、重要信号通路、肿瘤微环境、代谢过程、外周免疫、机械力与癌症转移等方面的最新进展。 |
2024年8月2日,南京医科大学第一附属医院王学浩院士团队在期刊《Signal Transduction and Targeted Therapy 》上发表了题为“Mechanism insights and therapeutic intervention of tumor metastasis: latest developments and perspectives”的研究论文。在这篇综述中,团队从各个角度描绘了肿瘤转移的遗传转变和前瞻性治疗干预措施。随着科学界向临床实施的进展,当务之急是不要将注意力仅仅集中在肿瘤上,而是要纳入全面的患者评估。

https://www.nature.com/articles/s41392-024-01885-2#Sec4
研究背景
01
在全球范围内,癌症是导致死亡的主要原因,世界卫生组织将超过90%的癌症相关死亡归因于转移。每年,约1,800万人接受癌症诊断,其中估计10-15%会出现转移。流行的癌症包括乳腺癌、肺癌、结肠癌、直肠癌和前列腺癌。某些癌症,包括胰腺癌、肝癌、子宫癌和肉瘤,死亡率停滞不前,甚至不断上升。令人震惊的是,尽管进行了70年的癌症治疗研究,但转移性疾病患者的5年生存指数仍然令人沮丧,实体瘤的生存指数在5%至30%之间波动。
虽然原发性肿瘤可能适合于局部手术或放射治疗等根治性干预措施,但转移表现出全身性倾向。其管理需要将化疗、靶向疗法和免疫疗法等相结合。下一代测序技术与复杂的计算数据解释相结合,重新定义了科学界对癌症发病和进展基因组基础的看法,为疾病轨迹和药物反应性提供了宝贵的见解。这种理解的加深,加上针对癌症基因组的疗法的出现,推动了基因组诊断方法在癌症管理中的临床整合。创新的临床试验框架,如伞式试验、篮式试验和平台试验,简化了药物审批。本文深入探讨了转移相关基因、肿瘤微环境(TME)、代谢过程、外周免疫、机械力和癌症转移的最新进展。此外,结合最近的进展,团队强调了开发有效干预措施,以对抗转移的障碍和前景。
研究进展
02
基于过继细胞转移(ACT)的免疫疗法
基于ACT的免疫疗法,为治疗转移性癌症,提供了一种新方法。这种形式的免疫疗法,是为个体患者量身定制的。通过在体外诱导肿瘤相关抗原特异性T细胞的分化、修饰和扩增,可以产生大量的T细胞。当这些细胞转移到肿瘤患者身上时,可以抑制和根除肿瘤细胞。在ACT中利用天然发生或基因工程化的T淋巴细胞,对转移性癌症患者,具有潜在的治疗益处。目前的临床方法,以肿瘤浸润淋巴细胞(TIL)、嵌合抗原受体T细胞 (CAR-T)和T细胞受体修饰T细胞(TCR-T)为主要特征。虽然TILs和TCR-T疗法,可以靶向细胞外和细胞内抗原谱,并保持长时间的体内活性,但其临床应用受到中等抗肿瘤功效和显著副作用的限制。CAR-T细胞具备抗原特异性和细胞活化双重能力,可选择性地排除肿瘤细胞。然而,需要进一步的证据来证实其治疗效果。ACT中自体淋巴细胞的基因修饰,以增强其抗肿瘤效力,为未来的癌症治疗提供了有希望的途径。
CAR-T和TCR-T都代表了ACT的先进模式,它们都使用自体淋巴细胞,来靶向各种癌症形式。ACT在多达40%的接受治疗的患者中,实现了完全、持续的缓解。CAR-T细胞面临的一个重大挑战,特别是在实体瘤中,是免疫抑制性肿瘤微环境,其特征是抑制因子(包括TGF-β)浓度升高。TME内基质细胞的遗传稳定性,与肿瘤细胞中公认的遗传异质性形成鲜明对比,因此,TME是一个潜在的治疗靶点。
TIL疗法代表了一种新兴的基于细胞的免疫疗法。由于肿瘤微环境的复杂性,TILs表现出有限的肿瘤根除能力。因此,TIL在体外扩增,然后重新引入患者体内。从理论角度来看,即使肿瘤缺乏可识别的驱动突变,当CAR-T细胞不能浸润实体瘤,或者当ICIs在“冷”肿瘤中无效时,TIL疗法也可能适用。一项研究表明,转移性宫颈癌患者在单次服用HPV-TIL后可持续完全缓解,从而凸显其潜力。扩增后,只有一部分TIL在回输时,对已建立的肿瘤新抗原保持反应性,这给提高反应性TCR品种的比例,带来了挑战。TIL的治疗结果受许多参数的影响,包括肿瘤特征、肿瘤负荷、TIL来源和质量、细胞计数、给药方案、淋巴引流和治疗前策略。因此,治疗计划必须根据每个患者的个体需求精心定制。与ATC治疗相关的主要不良反应,包括细胞因子释放综合征(CRS)和神经毒性。使用糖皮质激素或托珠单抗,可能会减轻这些负面后果。然而,复杂的准备程序和高昂的成本,对该方法的广泛临床应用,构成了重大挑战。

与肿瘤转移相关的经典信号通路。其中,MAPK、PI3K-AKT、TGF-β、JAK-STAT是基于磷酸化的信号通路,被细胞外激活因子级联扩增到细胞中,最终进入下游核转录调控。Wnt和NF-κB信号通路是基于磷酸化和蛋白质泛素化降解的信号形式,也被广泛表达。Notch是一种蛋白质剪切依赖性信号转导模式。将STING通路与其他几种免疫信号机制区分开来的一个重要特征是,其激活是由DNA触发的,因此,缺乏病原体特异性。
纳米技术
纳米技术提供了一种针对转移性癌症的有效治疗策略。纳米材料由于其设计,可以靶向特定的组织,甚至特定的亚细胞区域。纳米颗粒可以将复杂的分子货物运输到关键的转移部位,如淋巴结、肝脏和肺,并专注于这些器官内的特定细胞亚群。
转移级联反应的每个阶段,对于转移瘤的形成,都至关重要。靶向与该级联反应有关的免疫细胞,对于转移性癌症的管理至关重要。鉴于纳米材料(及其药物货物)调节免疫反应的潜力,针对免疫细胞的纳米医学策略,正在引起人们的极大关注。纳米粒子可以通过多种机制启动肿瘤凋亡,包括直接诱导肿瘤细胞死亡、树突状细胞触发的先天免疫反应和T细胞介导的适应性免疫反应。特殊设计的超分子阳离子金纳米棒,可以作为CRISPR/Cas9靶向PD-L1的递送机制,放大免疫检查点阻断(ICB)的功效。纳米泡(NBs)也被认为是癌症免疫疗法的潜在增强剂。
癌症诊断学使用纳米技术整合了成像和治疗方式。计算机断层扫描中使用的许多造影剂都是小分子,体内半衰期短暂。将这些试剂封装在纳米颗粒中,可以延长其停留时间,从而可能减少必要的剂量。对于转移性癌症患者,这可能会降低毒性,同时增强显像剂的特异性和信号强度,从而促进外科手术过程中转移的可视化。纳米材料有助于手术切除,识别循环肿瘤细胞,并精确定位特定的肿瘤亚区域。此外,纳米材料在光疗中,具有潜在的应用。通过开发基于介孔二氧化硅纳米颗粒(MSN)的创新纳米药物,可以增强化疗的疗效。
微纳机器人(MNR)辅助诊断和治疗的最新进展,为肿瘤学中基于MNR的治疗策略,铺平了道路。基于DNA的纳米机器人系统,已被设计用于递送具有不同生物活性的药物,这些药物不适合传统的治疗递送,用于靶向肿瘤治疗。模拟凝血级联反应,设计了一种纳米颗粒介导的选择性肿瘤血管梗死策略。这种方法需要将凝血酶负载的DNA纳米机器人(Nanorobot-Th)特异性递送至肿瘤脉管系统,诱发血管梗死、血管内血栓形成,从而引起肿瘤坏死。
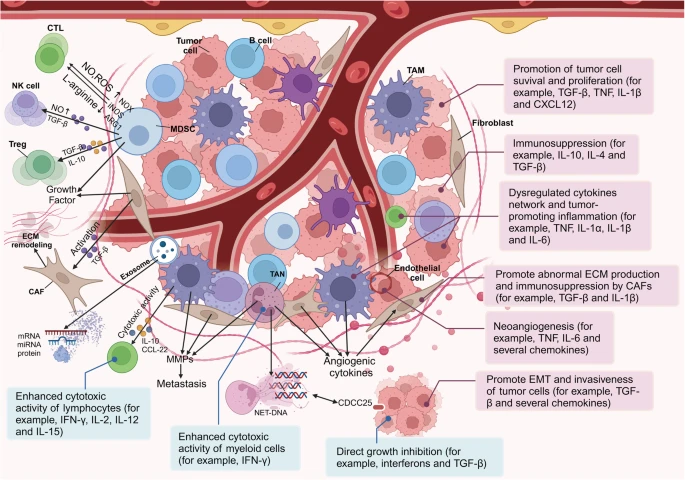
肿瘤微环境图显示了代表性的细胞类型、信号转导因子和各种细胞因子,以及它们的作用机制。在肿瘤部位,免疫细胞通常会获得与肿瘤相关的免疫抑制表型,但杀死癌细胞的细胞毒性CD8淋巴细胞(CTL)除外。髓源性抑制细胞(MDSC)通过各种机制抑制免疫。MDSCs还可以诱导T调节细胞(Treg)抑制自然杀伤(NK)细胞,并促进具有2 型表型的肿瘤相关巨噬细胞(TAM)。成纤维细胞变成癌症相关成纤维细胞(CAF),促进细胞外基质(ECM)重塑。各种细胞释放的细胞外囊泡含有影响微环境的蛋白质、mRNA和microRNA。纤维化细胞因子募集免疫细胞。中性粒细胞受刺激后释放的中性粒细胞胞外陷阱(NET)可以捕获癌细胞。TAMs、TAN和CAF释放血管生成细胞因子和基质金属蛋白酶(MMP),促进血管生成和ECM降解,并促进潜在的转移。此外,细胞因子的作用,用红色(促进肿瘤)和蓝色(抗肿瘤)矩形表示。一些细胞因子,如转化生长因子-β(TGF-β),可以产生双重作用,根据情况既作为抗肿瘤因子,又作为肿瘤促进因子。
研究结论
03
解决耐药性问题仍然至关重要,抗癌药物的组合,被认为是抵消或延缓多种耐药机制表现的潜在策略。科学界正在努力设计下一代ATP结合盒(ABC)转运蛋白抑制剂,以改善耐药性。从表观遗传学的角度来看,耐药性被认为是由肿瘤细胞表观遗传结构的改变引起的。整合素结合、应激反应和代谢重编程等信号通路的汇合,是癌症转移和耐药性发生的基础。信号转导环境中的这些中心节点,可能预示着加强抗癌干预措施的创新途径。这些信号转导枢纽在转移进展和治疗耐药性中的同时出现,使它们成为治疗靶向的主要候选药物。鉴于肿瘤产生的免疫抑制先兆,肿瘤微环境成为潜在的靶点。新兴研究聚焦于转移性和耐药性相关信号转导架构中的节点,表明了传统策略的转变。这可能会导致增强的抗癌方案,特别是关注淋巴结畸变和转移性实体。scRNA-seq和基因组评估的进展,进一步阐明了TME内错综复杂的适应性网络,揭示了耐药性与肿瘤增殖之间的联系,强调了精准治疗方式的重要性。
同时,推动个性化癌症管理旨在微调药物筛查,确保有针对性的干预措施,并最大限度地减少耐药性。人工智能成为支持该领域研究工作的潜在资产。纳米机器人代表了一种前卫的药物输送范式,可提高药物效率,并实现精确的癌症治疗。活性肿瘤细胞作为该药物部署的定制靶点,确保最佳的肿瘤靶向,同时保护周围的健康组织和器官完整性。这确保了治疗效率的提高,同时将不良反应降至最低。外泌体因其作为药物输送管道的潜在效用,而受到关注。EV的特点是毒性降低、生物相容性提高、免疫原性低和保护性磷脂双层,有望发挥持续的药物作用。
患者来源的肿瘤异种移植(PDX)模型,涉及将患者来源的肿瘤组织的原代细胞,移植到免疫缺陷小鼠中。由于PDX模型能够密切预测临床结果,因此,在新药开发的关键阶段(包括药物筛选),越来越受到重视。预计未来几年,PDX模型将在抗肿瘤药物筛选、临床剂量推荐和个体化肿瘤患者治疗领域,产生有价值的见解。
此外,人们越来越重视将多组学和单细胞测序技术,整合到临床试验设计中。这种整合可以深入了解局部治疗反应和转移共发生的细胞和分子效应。掌握广泛的遗传数据集,对于制定个性化、多模式的治疗方法,至关重要。
肿瘤转移是一种多方面的疾病,不仅仅包括单一的器官或基因异常。在这篇综述中,团队从各个角度描绘了肿瘤转移的遗传转变和前瞻性治疗干预措施。随着科学界向临床实施的进展,当务之急是不要将注意力仅仅集中在肿瘤上,而是要纳入全面的患者评估。必须考虑个体器官健康状况、原发性和转移性病变之间的相互关系,以及潜在的副作用等因素。基因特异性治疗和系统性整体方法的融合,可能代表管理癌症转移的最有效策略。
参考资料:
1.Kratzer, T. B. et al. Cancer statistics for American Indian and Alaska Native individuals, 2022: including increasing disparities in early onset colorectal cancer. CA Cancer J. Clin. 73, 120–146 (2023).
2.Ma, B., Wells, A. & Clark, A. M. The pan-therapeutic resistance of disseminated tumor cells: Role of phenotypic plasticity and the metastatic microenvironment. Semin. Cancer Biol. 60, 138–147 (2020).
 腾讯登录
腾讯登录







还没有人评论,赶快抢个沙发