协同免疫方法,助力癌症治疗!北京大学崔立刚、梁晓龙联合发文
| 导读 | 免疫疗法在结直肠癌治疗中显示出良好的潜力,然而,低反应率和严重的免疫相关药物副作用仍然阻碍了其治疗效果。 |
2024年3月29日,北京大学崔立刚教授和梁晓龙研究员共同通讯在《Advanced Science》上发表题为“Regulation of CTLs/Tregs via Highly Stable and Ultrasound-Responsive Cerasomal Nano-Modulators for Enhanced Colorectal Cancer Immunotherapy”的研究论文,本研究提供了一种高度稳定、超声可控(US-controllable)的智能递送系统,以实现协同声力免疫治疗,增强结直肠癌治疗。

https://onlinelibrary.wiley.com/doi/10.1002/advs.202400485
研究背景
01
近年来,利用人体免疫系统对抗不同肿瘤的免疫疗法取得了巨大成功。然而,低反应率和免疫相关药物副作用阻碍了这种有前途的疗法的临床应用。除了众所周知的免疫检查点阻断(ICB)疗法外,如单克隆程序性细胞死亡蛋白1(PD1)或程序性死亡配体1(PD-L1)抗体介导的PD1/PD-L1轴阻滞,以激活耗竭的T细胞,调节细胞毒性T淋巴细胞(CTL)和调节性T细胞(Tregs)的瘤内平衡是增强癌症免疫治疗的另一种有效策略, 因为浸润CTL的肿瘤细胞杀伤功能通常被上调的Tregs抑制,导致免疫稳态和肿瘤进展。因此,通过向肿瘤递送激动剂或阻断免疫治疗剂来调节这些T细胞受体介导的阳性或阴性信号,可以实现有效的癌症免疫治疗。
然而,在系统地施用免疫治疗药物(如不同的单克隆抗体、细胞因子或佐剂)时,正常组织中的非特异性生物分布和肿瘤部位的有限积累往往是不可避免的,从而导致潜在的免疫相关副作用和治疗效率差。为了避免这些问题,已经开发了水凝胶或肿瘤微环境 (TME)反应性免疫纳米调节剂,用于局部激活抗肿瘤免疫。然而,这种策略不适用于看不见或无法接近的肿瘤,也不适合复杂的制造过程。更重要的是,肿瘤的异质性会导致药物释放不均匀、不可控,难以及时调整和需要。免疫治疗药物通过外界刺激的可控递送似乎更具优势,可以在复杂的TME中实现药物释放的实时调节。因此,非常需要使用外部刺激来远程和特异性激活肿瘤免疫反应并减少免疫相关副作用的替代方法。
研究结果
02
本文制备了一种由神经形成脂质(CFL)、PL偶联物、不饱和DOPC脂质和DMC组成的高度稳定且US反应性神经体调节剂DMC@P-Cs,用于US引发的癌症声动力学免疫治疗。由此产生的DMC@P-Cs与US结合可以特异性产生ROS,同时触发DMC从DMC@P-Cs释放,从而特异性增强CTLs的浸润,并下调肿瘤部位的Tregs,以抵消肿瘤免疫耐受性(图1)。具有硅酸盐表面的DMC@P-C在血液循环过程中保持稳定,从而减少DMC的释放和与正常组织的接触。DMC@P-Cs通过增强通透性和保留性(EPR)效应在肿瘤部位被动积累,当US局部施加到肿瘤上时,可以被激活产生ROS并释放DMC,在此过程中,角质体双层中的不饱和脂质DOPC可以被产生的ROS过氧化,导致DMC的局部释放。与SDT联合使用,DMC@P-Cs可通过ROS的产生触发肿瘤抗原释放产生ICD,促进CTLs在肿瘤中的浸润,同时通过释放的DMC降低Tregs,从而显著提高CTLs/Tregs比值。此外,该系统的全身不良反应可以忽略不计。总而言之,构建的神经小体提供了一个强大的纳米平台,可以局部递送免疫调节剂以增强癌症免疫治疗。
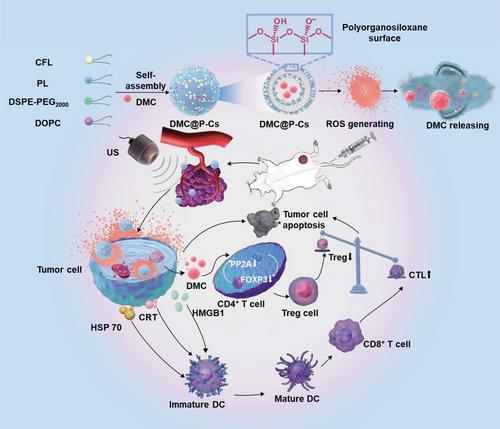
DMC@P-Cs的制作图以及向肿瘤递送超敏剂和免疫抑制剂,以实现CT26肿瘤的声动力学治疗与免疫治疗相结合。(转化医学网360zhyx.com)
参考资料:
https://www.cell.com/cell/fulltext/S0092-8674(24)00240-X
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录







还没有人评论,赶快抢个沙发