最新!中山大学研究揭示抑制“癌症转移”的新机制
| 导读 | 转移已成为鼻咽癌(NPC)患者治疗失败和死亡的主要原因。越来越多的证据表明,异常的DNA甲基化与鼻咽癌的发生和发展有关。然而,我们这些过程背后的确切监管机制仍然知之甚少。 |
近日,中山大学研究人员在期刊《Journal of Experimental & Clinical Cancer Research》上发表题为“The E3 ligase NEURL3 suppresses epithelial-mesenchymal transition and metastasis in nasopharyngeal carcinoma by promoting vimentin degradation”的研究论文,研究揭示了NEURL3抑制鼻咽癌转移的新机制,从而为鼻咽癌治疗提供了有希望的治疗靶点。

https://jeccr.biomedcentral.com/articles/10.1186/s13046-024-02945-9
背景介绍
01
鼻咽癌(NPC)是一种起源于鼻咽上皮的恶性肿瘤,具有明显的地理异质性,在华南、东南亚和北非地区患病率较高。这种独特的分布归因于遗传易感性、饮食和感染因素等。调强放疗(IMRT)的应用及其与化疗的联合治疗显著改善了该病的局部区域控制,远处转移成为鼻咽癌治疗失败和癌症相关死亡的主要原因。因此,亟需更好地探索鼻咽癌转移的调控机制,指导鼻咽癌患者更加个性化的治疗。
全基因组和外显子组测序显示,NPC患者很少发生突变、缺失、扩增等基因组改变。作为一种表观遗传修饰,DNA甲基化被认为是鼻咽癌的结石特征。泛素-蛋白酶体系统在调节蛋白质降解、功能和亚细胞运输以维持细胞稳态方面起着关键作用。在这个过程中,E3泛素连接酶赋予经历泛素化的底物特异性,从而赋予E3调节几乎所有细胞蛋白的定位、活性、相互作用和丰度的能力,并对细胞生物学的各个方面产生影响。E3连接酶活性的异常调节在各种病理条件下具有深远的影响,特别是在肿瘤发生方面。E3连接酶的异常表达导致不受控制的细胞增殖和永生化、上皮-间充质转化(EMT)、肿瘤侵袭和转移。最近的研究还揭示了 DNA 高甲基化和 E3 连接酶之间的显著关联,导致鼻咽癌的放射耐药性增加和肿瘤转移增强。
在这里,我们通过对两个全基因组DNA甲基化微阵列数据集的综合分析,确定了神经化E3泛素蛋白连接酶3(NEURL3)在鼻咽癌中高度甲基化。NEURL3最初在脂多糖诱导后的小鼠肺泡上皮细胞中被表征,它可以调节宿主抗病毒免疫、肺胚胎发生和精子发生。然而,在肿瘤发生和进展中的确切调节作用仍不清楚。我们发现 NEURL3 的下调归因于其启动子高甲基化,表明鼻咽癌患者的预后不良。NEURL3 的过表达通过促进泛素-蛋白酶体途径中波形蛋白的降解来抑制 NPC 细胞 EMT、迁移、侵袭和转移。
研究结果
02
在我们目前的研究中,我们证明 NEURL3 的启动子区域在 NPC 中通常被高甲基化,导致 NEURL3 的表达降低。NEURL3低表达与鼻咽癌患者预后不良相关,提示肿瘤转移。NEURL3的过表达在体外和体内均显著抑制鼻咽癌转移和EMT。从机制上讲,NEURL3 依赖于其 E3 连接酶活性,促进了波形蛋白在 K97 位点的 K48 连接多泛素化,从而促进了波形蛋白的蛋白质降解。波形蛋白表达的恢复可以充分挽救NEURL3过表达对鼻咽癌细胞迁移和侵袭的抑制作用。我们的研究揭示了NEURL3促进波形蛋白降解以抑制鼻咽癌转移的新机制(图7j),从而为鼻咽癌治疗提供了有前途的治疗靶点。
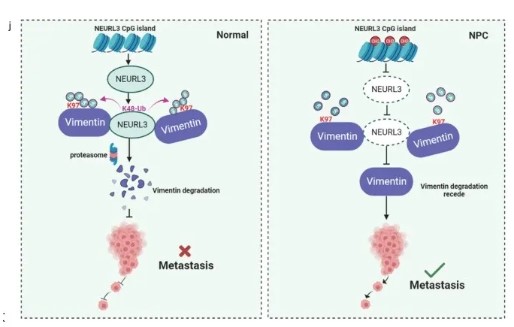
模式图。NEURL3 在泛素-蛋白酶体途径中促进波形蛋白的降解,抑制鼻咽癌转移(左图)。在鼻咽癌中,NEURL3 的启动子高甲基化导致其下调,使波形蛋白表达增加以促进鼻咽癌转移(右图)。
研究结论
03
总之,我们证明 NEURL3 由于其启动子高甲基化而在 NPC 中下调,导致 NPC 患者预后不良和治疗后远处转移。NEURL3 通过泛素-蛋白酶体途径募集并促进波形蛋白的蛋白质降解,从而通过灭活 EMT 来抑制鼻咽癌转移。我们的研究揭示了NEURL3抑制鼻咽癌转移的新机制,为鼻咽癌患者提供了新的治疗靶点。根据我们的研究结果和现有研究,调节 E3 泛素连接酶或去泛素化酶以抑制鼻咽癌的 EMT 和转移,对于提高鼻咽癌治疗的临床效果具有巨大的前景。(转化医学网360zhyx.com)
参考资料:
https://jeccr.biomedcentral.com/articles/10.1186/s13046-024-02945-9
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录







还没有人评论,赶快抢个沙发