重要发现!厦门大学发现去甲基化酶PHF8促癌新机制及靶向PHF8特异性小分子抑制剂
| 导读 | 高水平的线粒体活性氧 (mROS) 与癌症发展有关,而癌症发展受到电子传递链 (ETC) 的严格控制。然而,控制ETC基因转录以驱动mROS产生和癌细胞生长的表观遗传机制仍有待完全表征。 |
2024年1月2日,厦门大学药学院刘文教授研究团队与吴振教授研究团队于PNAS在线发表题为“Targeting the PHF8/YY1 Axis Suppresses Cancer Cell Growth Through Modulation of ROS”的研究成果。研究强调了PHF8的共阻遏蛋白作用,该作用在表观遗传学上许可ETC(电子传递链)基因转录和mROS(线粒体活性氧)的产生,以促进癌细胞增殖,从而为癌症治疗提供概念验证治疗靶点。

https://www.pnas.org/doi/10.1073/pnas.2219352120
研究背景
01
活性氧 (ROS)是细胞内进行有氧代谢产生的单电子还原产物,作为胞内重要的信号分子发挥重要功能。癌症中ROS 水平升高被认为是癌症的标志之一,并与癌症的发生发展密切相关。其中,线粒体对细胞 ROS (mROS) 的贡献最大。在线粒体呼吸过程中,由线粒体电子传递链 (ETC) 将电子从三羧酸 (TCA) 循环转移到末端电子受体 O2,从 ETC 泄漏的电子与 O2反应生成 O2−,ETC 失调会导致 mROS 的产生增加。然而,调控 ETC 基因转录以驱动 mROS 产生和癌细胞生长的表观遗传机制仍有待充分表征。
PHF8 是一种含有植物同源结构域手指和 Jumonji C (JmjC) 结构域的蛋白质,在 X 连锁智力低下 (XLMR) 和唇腭裂患者中发生突变。PHF8 过表达已在各种癌症类型中得到证实,突出了 PHF8 的致癌作用。PHF8 被称为组蛋白赖氨酸去甲基化酶,可去除抑制性组蛋白标记 H3K9me1/2、H3K27me2 和 H4K20me1。PHF8在生理和病理方面的功能研究主要集中在其作为转录共激活因子的作用上。PHF8的调节功能很大程度上取决于其酶活性。
研究进展
02
本研究,我们首先通过质谱和ChIP-seq技术发现了PHF8和转录因子YY1的相互作用,并在染色质上共定位于基因启动子处(尤其是ETC基因)。接下来,我们研究发现PHF8去甲基化YY1并调控其DNA结合能力以及对PHF8/YY1共结合的ETC基因(PY-ETC)发挥转录抑制作用,促进线粒体ROS产生,从而驱动肿瘤细胞生长。这一调控机制被证实在包括结肠癌和肺癌在内的多种癌症中具有临床意义。此外,我们通过筛选发现了一个选择性高、活性强的PHF8抑制剂iPHF8。iPHF8能有效抑制结肠癌和肺癌中PHF8介导的YY1去甲基化、调控PY-ETC基因转录、抑制线粒体ROS产生和肿瘤生长。
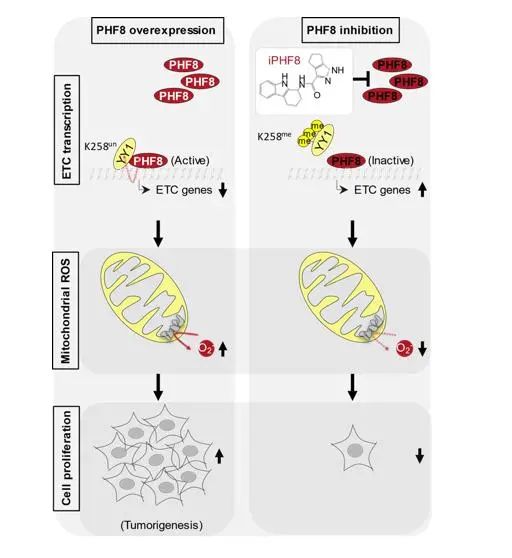
模式图:PHF8介导的YY1 K258去甲基化在ETC基因转录调控、mROS产生和肿瘤细胞生长中的作用机制和靶向干预研究
综上,该研究揭示了PHF8介导的YY1去甲基化参与ETC转录调控的关键表观遗传机制,证实了PHF8是极具潜力的癌症治疗靶点。研究所发现的iPHF8小分子为进一步的药物研发提供了方向。
研究结论
03
在目前的研究中,我们报道了 PHF8 可以作为转录共阻遏因子,通过直接去甲基化非组蛋白底物 YY1 来调节大部分 ETC 基因,从而驱动 mROS 的产生和癌细胞生长。我们鉴定了一种小分子抑制剂 iPHF8,它在抑制小鼠细胞系和患者来源的异种移植物中 mROS 的产生和癌细胞生长方面表现出特异性和有效的活性。因此,iPHF8 是第一个靶向 PHF8 酶活性的特异性化学抑制剂,其药代动力学和安全性值得进一步研究。(转化医学网360zhyx.com)
参考资料:
https://www.pnas.org/doi/10.1073/pnas.2219352120
https://pharm.xmu.edu.cn/2024/0104/c19556a482737/page.htm#
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发