新型生物标志物!中南湘雅研究团队发文:揭示非小细胞肺癌免疫治疗策略
| 导读 | 非小细胞肺癌(NSCLC)是全球死亡的主要原因。 |
11月17日,中南大学湘雅医院孙仑泉、翁良共同通讯在期刊《Cell Reports》上在线发表题为“E3 ligase Trim35 inhibits LSD1 demethylase activity through K63-linked ubiquitination and enhances anti-tumor immunity in NSCLC”的研究论文,研究揭示了Trim35作为一个E3连接酶参与了LSD1 K63泛素化的调控,导致了对LSD1去甲基化酶活性的抑制。Trim35可以作为一个生物标志物评估LSD1的活性,并预测免疫检查点抑制疗法(ICB therapy)的预后。通过使用LSD1抑制剂,可以显著改善低表达Trim35的非小细胞肺癌的低免疫原性状态,暗示了一种有前途的免疫治疗耐药肺癌的治疗策略。

https://www.cell.com/cell-reports/fulltext/S2211-1247(23)01489-4
研究背景
01
非小细胞肺癌(NSCLC)是全球死亡的主要原因。由于免疫系统在肿瘤发生和进展中发挥着关键作用,因此免疫检查点PD-1的阻断已经成为革命性的非小细胞肺癌治疗方法,并且对患者显示出长期益处。然而,只有大约30%的非小细胞肺癌患者可以从PD-1的阻断中受益,大多数患者对这种治疗没有反应,原因包括PD-L1表达不足、肿瘤细胞免疫原性低、T细胞功能失调,或是缺乏T细胞浸润肿瘤微环境。因此,迫切需要揭示PD-1阻断耐药的机制,以提高抗PD-1疗法的疗效。
LSD1在多种癌症中促进肿瘤的增殖和进展,包括肺癌。 已经有几种LSD1抑制剂在临床试验中用于癌症治疗的评估。尽管这些抑制剂,比如TCP或ORY-1001,显示出了一些有希望的效果,但是化合物的不良反应和临床反应的无关紧要导致了试验的失败,这可能是由于缺乏排除活性不高的LSD1的患者的标准所致。因此,发现能够准确识别具有高LSD1活性的患者的生物标志物可能会克服这些问题,并扩大LSD1抑制剂在癌症治疗中的应用。
蛋白质活性通常受到翻译后修饰(PTM)的调控,其中包括泛素化,该过程由泛素激活酶(E1)、泛素连接酶(E2)和泛素连接酶酶(E3)构成的酶级联催化。已经报道了几种LSD1去泛素化酶,比如USP7、USP28和OTUD7B,据称它们可以调节LSD1的稳定性。然而,目前尚不清楚是否存在其他类型的泛素化修饰可以调节LSD1的活性或功能,而非蛋白质稳定性。因此,发现一个针对LSD1的新型E3连接酶可能会导致LSD1活性生物标志物的发现。
三部件结构域(Trim)家族蛋白大多具有E3泛素连接酶活性,执行着各种细胞功能,如细胞内信号传导、先天免疫、转录、自噬和致癌过程。然而,大多数Trim蛋白的功能尚不清楚。
研究发现
02
在研究中,研究人员确定了一个E3连接酶,Trim35,作为LSD1高活性的有效生物标志物,用于预测LSD1靶向治疗以及免疫治疗的预后。在机制上,Trim35通过介导LSD1赖氨酸位点422的K63泛素化来抑制LSD1的去甲基化酶活性。抑制LSD1活性有利于ERGIC1转录,随之而来的是自噬抑制和IFNGR1稳定,从而激活IFN-γ信号传导,导致MHC I类表达增加和对非小细胞肺癌细胞的免疫监视增强。此外,联合使用LSD1抑制剂和抗PD-1疗法可以显著清除具有低Trim35的免疫原性较差的肺癌。这些发现强烈表明Trim35是预测非小细胞肺癌免疫治疗结果的有希望的生物标志物。
Trim35通过上调肿瘤免疫原性和
T细胞浸润来抑制非小细胞肺癌的进展
03

为了研究Trim家族蛋白在非小细胞肺癌(NSCLC)中的参与情况,研究人员检查了来自癌症基因组图谱(TCGA)数据库的NSCLC队列中Trim蛋白的变异频率:https://www.cancer.gov/,发现Trim35基因的变异频率最高(19%)。在这些具有基因变异的患者中,大多数病例显示出Trim35的缺失或低表达。相比之下,大多数其他Trim家族基因在肺癌中是被放大或过表达的。此外,低Trim35表达与不良预后相关。为了研究Trim35在NSCLC中的作用,研究人员最初检查了其亚细胞定位,考虑到先前的报告指出主要为核内表达。
在癌组织中,与相配对的邻近正常肺组织相比,核内Trim35表达较低。低核内Trim35表达与较差的总体生存率相关,但与肿瘤分期或转移无关。在核内Trim35表达较低的肺癌组织中检测到较少的CD8+T细胞浸润。体外实验表明,Trim35功能的增益或丧失显著减少或促进了肺癌细胞的生长和克隆形成。这些结果表明,Trim35可能通过直接抑制肺癌细胞的生长并调节肿瘤免疫微环境,在NSCLC中发挥肿瘤抑制基因的作用。
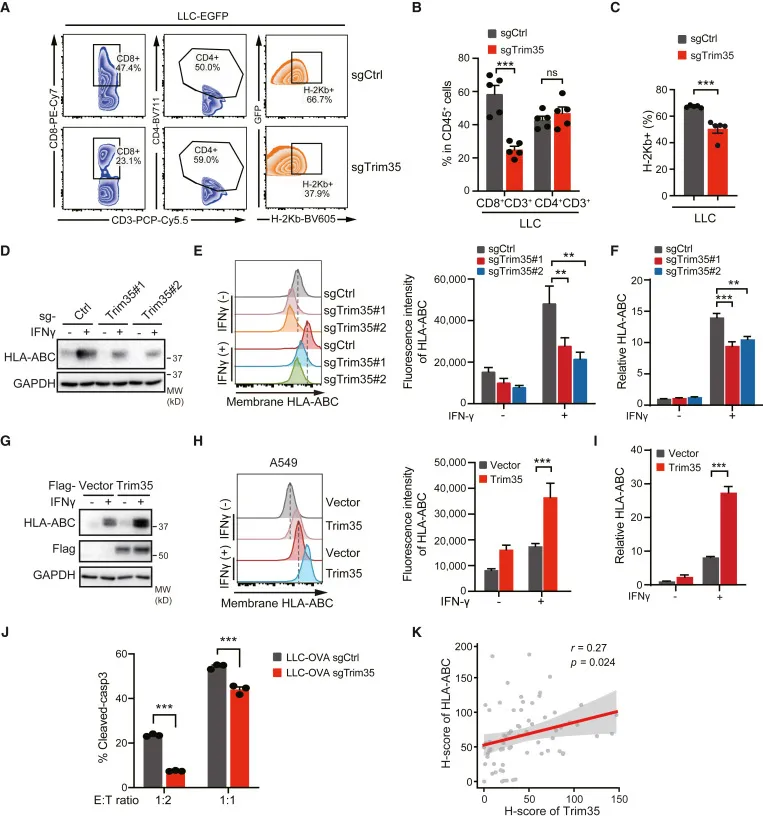
为了模拟在NSCLC中Trim35的临床缺失,并进一步研究Trim35对肿瘤进展的影响,研究人员利用CRISPR-Cas9在小鼠肺癌LLC细胞中破坏了Trim35,并将其植入免疫缺陷小鼠(BALB/c裸鼠)和免疫competent小鼠(C57BL/6)。研究人员观察到在Trim35敲除(KO)小鼠和C57BL/6小鼠中促进的肿瘤进展。在过表达Trim35的A549细胞注射的裸鼠中,肿瘤生长和Ki67表达显著减少。与裸鼠相比,Trim35 KO显著增加了C57BL/6小鼠的肿瘤大小,这表明Trim35不仅在肿瘤增殖中发挥作用,而且在抗肿瘤免疫中也起着作用。
为了验证发现,研究人员通过流式细胞术分析检查肿瘤微环境,并发现在Trim35-KO肿瘤中,肿瘤细胞上MHC-I类(小鼠中的H-2Kb)的表达和CD8+T细胞的浸润显著减少。Trim35对体外肺癌细胞中MHC-I类分子(人类中的HLA-ABC)表达的影响在进一步验证。在体外观察到了Trim35介导的LLC-OVA癌细胞对活化OT-I CD8+T细胞的敏感性。此外,在临床肺癌样本中发现了Trim35表达与MHC-I水平之间的正相关关系。这些结果揭示了Trim35通过直接抑制生长和免疫调节的方式作为肿瘤抑制因子,这与低Trim35表达的NSCLC的临床特征密切相关。
研究结果
04
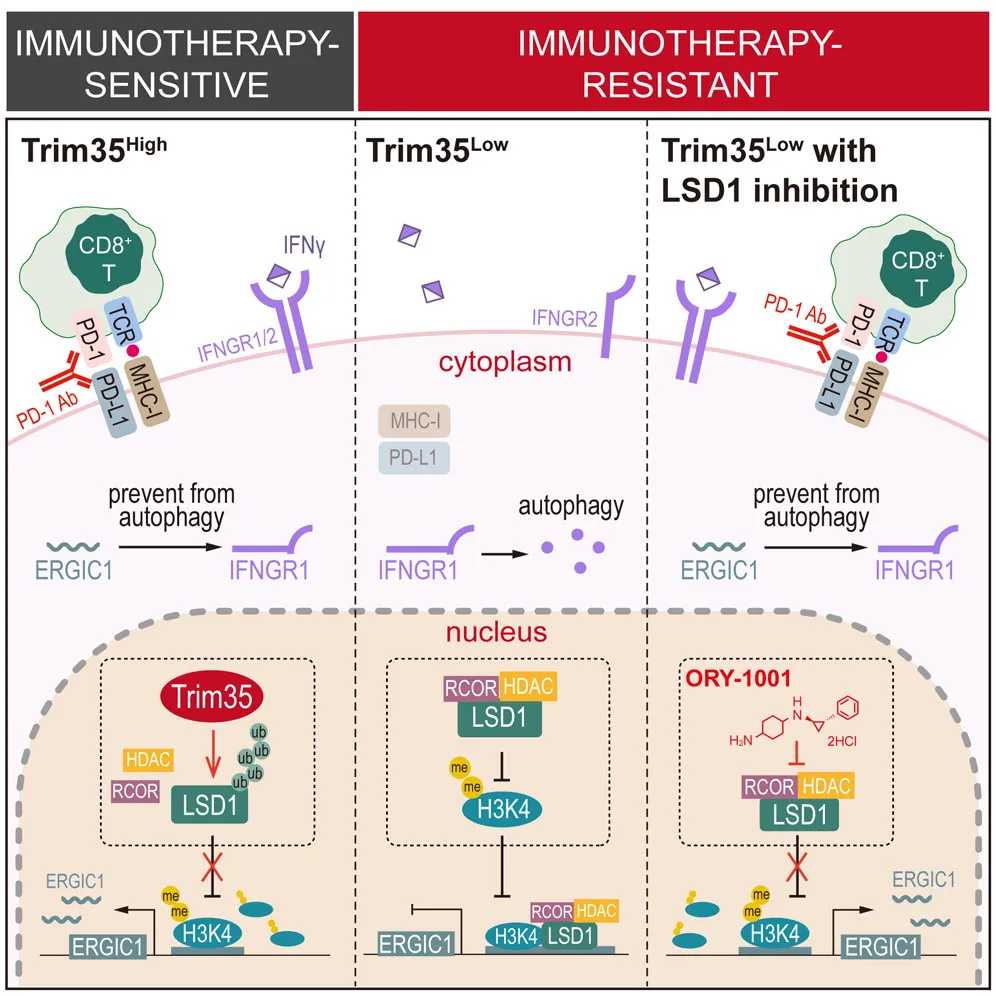
综上所述,研究揭示了Trim35作为一个E3连接酶参与了LSD1 K63泛素化的调控,导致了对LSD1去甲基化酶活性的抑制。Trim35可以作为一个生物标志物评估LSD1的活性,并预测免疫检查点抑制疗法(ICB therapy)的预后。通过使用LSD1抑制剂,可以显著改善低表达Trim35的非小细胞肺癌的低免疫原性状态,暗示了一种有前途的免疫治疗耐药肺癌的治疗策略。(转化医学网360zhyx.com)
参考资料:
https://www.cell.com/cell-reports/fulltext/S2211-1247(23)01489-4
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发