驱动“癌王”生长和转移!研究发现胰腺癌治疗新靶点
| 导读 | 胰腺导管腺癌(PDAC)是最致命的癌症之一,缺乏有效的治疗方法。 |
近日,美国阿拉巴马大学伯明翰分校的研究人员在国际期刊《Cell Reports Medicine》上发表了题为“HOXC6 drives a therapeutically targetable pancreatic cancer growth and metastasis pathway by regulating MSK1 and PPP2R2B”的研究论文,本研究中,研究人员证明转录因子HOXC6在大多数PDAC中过表达,并且对肿瘤的生长和转移是必需的。此外,研究人员证明了HOXC6抑制蛋白磷酸酶2调节亚基B β (PPP2R2B),蛋白磷酸酶2A的调节亚基,并激活核糖体蛋白S6激酶,也称为MSK1,以促进PDAC生长。联合药物抑制MSK1和哺乳动物雷帕霉素靶蛋白(mTOR)抑制剂可有效抑制PDAC肿瘤的生长和转移。此外,在PDAC细胞中对MSK1和mTOR抑制剂的获得性耐药模型显示,获得性对MSK1和mTOR抑制剂均耐药的PDAC细胞对胰岛素样生长因子1受体(IGF1R)抑制剂敏感。最后,研究人员发现MEK抑制剂曲美替尼进一步增强SB-747651A和依维莫司联合治疗的疗效。综上所述,这些结果证明了HOXC6在PDAC肿瘤生长和转移中的驱动作用,并确定了PDAC治疗的替代治疗靶点。

https://doi.org/10.1016/j.xcrm.2023.101285
研究背景
01
胰腺导管腺癌(PDAC)是最常见的胰腺癌类型,每年导致全球40多万例死亡。在所有监测、流行病学和最终结果(Surveillance, Epidemiology, and End Results)分期中,晚期/不可切除的PDAC患者的5年总生存率估计约为12%,而有远端转移的患者的5年总生存率降至约3%。在过去20年中,PDAC的治疗方法不断发展,但手术切除仍然是可能治愈这种癌症的唯一可能方法。目前的治疗方案包括FOLFIRINOX或吉西他滨联合其他化疗药物,如白蛋白结合型紫杉醇、厄洛替尼或免疫疗法。然而,在为PDAC患者提供持久临床获益方面,上述每种疗法均存在显著局限性。因此,需要更好地了解PDAC依赖性,从而为这些患者开发更有效的治疗方法。
转录调控失调在多种癌症的生长和转移中起着至关重要的作用。其中,转录因子的过度表达是导致癌细胞转录失调的普遍机制。因此,研究人员期待以前未被记录的转录因子驱动的致癌分子网络的发现将揭示新的癌症治疗选择。
同源盒(HOX)家族转录因子由DNA结合蛋白组成,可激活或抑制转录。HOX基因已被证明在癌症和其他人类疾病中失调。特别是HOX基因在癌症中发生突变或过度表达,并在某些癌症的发生发展中发挥直接作用。
研究发现
02
超过90%的PDAC肿瘤携带KRAS基因突变,导致其组成型激活。KRAS的这种组成型致癌激活刺激多种致癌通路的表达,最显著的是MAPK和PI3K通路。研究人员发现PI3K/AKT通路负责PDAC中HOXC6转录的上调。这些发现表明,HOXC6是一个关键的TF,通过PI3K/AKT通路介导PDAC中致癌KRAS的一些致癌效应。本研究还发现CEBPB是通过PI3K/AKT通路调控的,并且是HOXC6表达所必需的。
机制分析表明,HOXC6通过抑制PPP2R2B的表达而激活mTOR通路的能力是其促进PDAC细胞生长的部分原因。mTOR通路作为代谢、细胞增殖和生存的调节因子发挥作用,其活性在几种癌症类型中升高,这反过来对肿瘤生长和进展至关重要。在PDAC中也观察到mTOR通路的激活。值得注意的是,mTOR通路具有药理学靶向性,一些mTOR抑制剂已在临床试验中评估用于治疗各种类型的癌症,支持该通路在癌症中的驱动作用。PP2A是一种异源三聚体丝氨酸/苏氨酸磷酸酶,参与许多调节过程,包括细胞生长和分裂以及转录调节。PP2A包含一个36-kD的催化亚基,一个高度同源的65-kD结构亚基,以及许多调节亚基,包括调节其特异性的PPP2R2B。既往研究表明,PPP2R2B在结直肠癌中因DNA高甲基化而表观遗传沉默,其缺失以pdk1依赖的方式导致MYC代偿性磷酸化,导致雷帕霉素耐药。此外,PPP2R2B表达降低与AKT/mTOR激活相关,从而促进癌细胞存活和增殖。PP2A还可负性调节AKT活性,主要是通过阻止Thr-308的磷酸化来实现。此外,与研究人员的发现相似,之前对HER2+乳腺癌的研究表明,PPP2RB可能通过调节mTOR通路。本研究表明,在PDAC中敲低HOXC6降低了mTOR通路的活性,这与HOXC6调节PPP2R2B表达的能力直接相关。另外,研究人员证明了PPP2R2B→mTOR轴调控hoxc6介导的PDAC生长。
研究人员发现HOXC6对PDAC细胞中MSK1的表达是必需的。此外,研究人员发现DDX17是MSK1的磷酸化靶点。DDX17是RNA解旋酶DEAD box (asp-glu-ala-asp/his)蛋白家族的成员,参与多种细胞功能。另外,之前的研究表明DDX17与癌症相关。在本研究中,研究人员证明了DDX17是MSK1的一个靶点,并且是其在PDAC中下游作用的介质,通过抑制细胞凋亡发挥作用。通过推测,研究确定MSK1→DDX17是一个显著促进HOXC6下游PDAC生长的轴。由于mTOR通路和MSK1都可以被药物抑制,本发现为PDAC的治疗提供了一个治疗机会。根据本研究,MSK1抑制剂和mTOR抑制剂的联合应用抑制了PDAC肿瘤的生长和转移。研究人员还想指出的是,由于在小鼠研究中观察到HOXC6敲低后原发肿瘤生长受到抑制,因此对转移的抑制可能部分归因于原发肿瘤生长受到抑制。
研究发现,IGF1R是对MSK1和mTOR抑制剂耐药的PDAC细胞的治疗靶点。IGF1R已被证明在其他类型的癌症中导致对其他靶向治疗药物的耐药性。此外,临床级抑制剂(如本研究中使用的BMS-754807)已经上市,其中一些正在临床试验中用于治疗一系列初治和耐药癌症。
因此,本研究结果强调了RTK(如IGF1R)作为治疗耐药性癌症药物的意义。本研究结果为PDAC的长期抑制提供了主要和次要治疗策略,从而扩大了PDAC患者的治疗选择。此外,MEK抑制剂曲美替尼、MSK1抑制剂和mTOR抑制剂联合治疗能够进一步增强对PDAC肿瘤生长和转移的抑制作用。
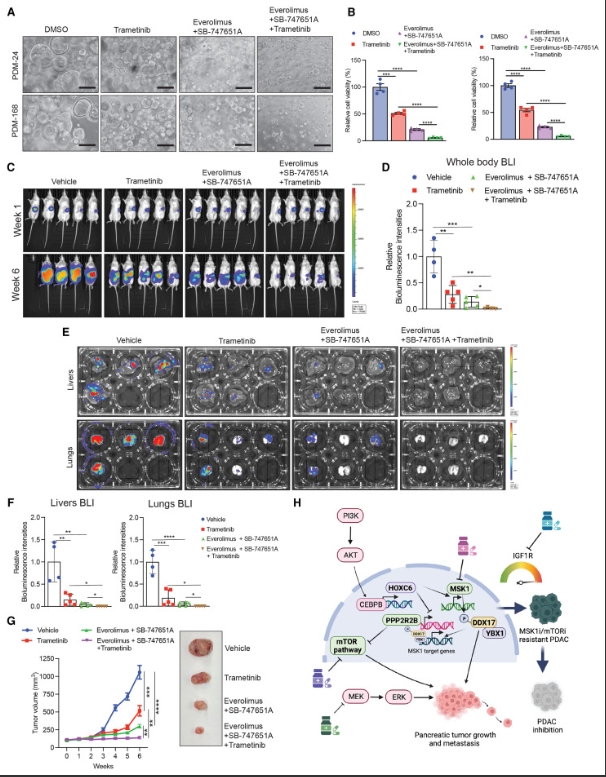
MSK1和mTOR抑制剂联合MEK抑制剂曲美替尼更有效地抑制PDAC肿瘤的生长和转移
研究结论
03
综上,本研究结果揭示了HOXC6及其下游靶点作为PDAC肿瘤生长和转移的促进剂,在药理学上适合PDAC治疗。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41419-023-06264-3#Sec26
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发