再取进展!武汉大学舒红兵团队揭示癌症靶向药物研究新进展
| 导读 | 各种细胞应激条件触发线粒体DNA (mtDNA)从线粒体释放到细胞质中。释放的mtDNA被cGAS-MITA/STING通路感知,导致I型干扰素等效应基因的诱导表达。这些过程有助于对病毒感染和其他应激因素的先天免疫反应。 |
2023年11月7日,武汉大学舒红兵及胡明明共同在《Cellular & Molecular Immunology》发表题为“Mitochondrial DNA-triggered innate immune response: mechanisms and diseases”的综述论文,该文章综述了mtDNA激活cGAS-MITA/STING通路的机制、该通路在各种生理病理条件下的作用,以及靶向cGAS和MITA/STING的药物研究进展。

https://www.nature.com/articles/s41423-023-01086-x
此前发文
01
2023年11月6日,武汉大学舒红兵及李姝共同在《Cell Research》发表题为“PD-1 signaling negatively regulates the common cytokine receptor γ chain via MARCH5-mediated ubiquitination and degradation to suppress anti-tumor immunity”的研究论文,该研究发现PD-1连接导致BATF依赖的膜相关E3泛素连接酶MARCH5的转录诱导,该酶介导k27连接的多泛素化和常见细胞因子受体γ链(γc)的溶酶体降解。PD-1连接也激活SHP2,使γcY357去磷酸化,导致γc家族细胞因子触发的信号通路受损。相反,PD-1阻断恢复γc水平和活性,从而使CD8+ T细胞对IL-2敏感。还发现Pitavastatin Calcium是一种MARCH5抑制剂,与PD-1阻断剂和IL-2联合使用可显著提高小鼠抗肿瘤免疫治疗的疗效。该研究揭示了PD-1信号拮抗γc家族细胞因子引发的免疫激活的机制,并表明其潜在机制可以用于提高癌症联合免疫治疗的疗效。

https://www.nature.com/articles/s41422-023-00890-4
研究背景
02
肿瘤免疫治疗的进展使肿瘤的治疗发生了革命性的变化。溶瘤病毒、细胞因子、过继性细胞转移和免疫检查点抑制剂等几种免疫疗法已获得持久的临床缓解。临床肿瘤免疫治疗的前沿是免疫检查点阻断(ICB)。免疫检查点分子如共抑制信号通路中的PD-1被进化用来控制T细胞反应的大小和持续时间,以限制组织损伤,并在生理和病理条件下维持自身耐受。然而,肿瘤细胞可以劫持这些抑制通路来逃避宿主的免疫监视,如通过过表达PD-1配体PD-L1。这为免疫检查点抑制剂在肿瘤免疫治疗中的临床应用提供了理论依据。临床上,阻断PD-1/PD-L1轴的抗体可使肿瘤微环境(TME)中耗竭的T细胞恢复活力,并在淋巴瘤和黑色素瘤等大量肿瘤中显示出显著的客观缓解和持久缓解,且毒性可接受。然而,并非所有患者对PD-1单药治疗均有应答,因此开发联合疗法以提高癌症患者的总缓解率,并引发更完全和更持久的缓解是相当有意义的。
常见细胞因子受体γ链(γc,又称CD132)是白细胞介素-2 (IL-2)、IL-4、IL-7、IL-9、IL-15和IL-21受体的组成部分。γc在多种免疫细胞中组成性表达;编码γc的基因(IL2RG)突变导致x连锁重度联合免疫缺陷。γc家族细胞因子在固有免疫和适应性免疫应答中具有多种功能,促进T、B、NK和固有淋巴细胞(ILCs)的发育,根据不同的环境促进免疫细胞的存活或死亡,并调节前体免疫细胞向终末分化细胞的分化。一些γc家族细胞因子,如IL-2、IL-9、IL-15和IL-21,由于其在调节T细胞、NK细胞等免疫细胞活性方面的重要作用,显示出较强的抗肿瘤作用。对γc家族细胞因子的研究使其在自身免疫性疾病和癌症方面取得了显著的转化进展。
在过去的几年里,肿瘤的联合免疫治疗显示出了巨大的前景。免疫检查点PD-1阻断联合γc家族细胞因子IL-2是一种很有前景的癌症免疫治疗组合,目前有多项临床试验正在进行中。IL-2因具有刺激细胞毒性T淋巴细胞和NK细胞增殖的能力而被认为是一种治疗肿瘤的药物。然而,只有大剂量的IL-2在某些癌症患者中显示出治疗效果,并且其广泛应用也受到全身毒性的限制,而PD-1阻断和IL-2联合治疗在癌症患者中非常有效。了解这种联合的协同作用的潜在机制对于设计更好的癌症免疫治疗策略很重要。
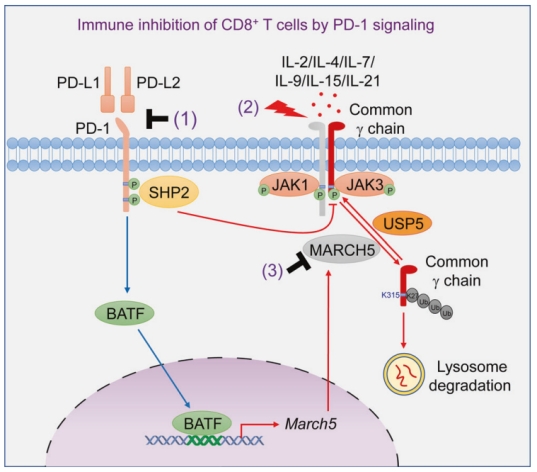
机理模式图
研究发现
03
在本研究中,研究人员发现PD-1信号通路转录诱导E3泛素连接酶MARCH5, MARCH5靶向γc进行k27连接的多泛素化和溶酶体降解。此外,PD-1信号还激活SHP2,从而介导γc去磷酸化和抑制γc家族细胞因子触发的信号传导。这些结果表明,PD-1信号通过两种不同的机制拮抗由细胞因子γc家族触发的免疫激活。与此同时,PD-1阻断恢复了肿瘤浸润CD8+ T细胞对γc家族细胞因子的反应。此外,在小鼠肿瘤模型中,一种MARCH5抑制剂显著提高了由PD-1阻断和IL-2触发的免疫治疗的疗效。本研究结果揭示了PD-1信号抑制γc家族细胞因子触发的CD8+ T细胞活化的机制,为提高肿瘤联合免疫治疗的疗效提供了潜在的靶点。
研究结论
04
综上,目前的研究表明,由PD-1信号触发的march5介导的γc降解和shp2介导的γc失活使TME中的CD8+ T细胞对γc家族细胞因子的免疫激活无反应。PD-1阻断治疗恢复γc的稳定性和活性,从而使CD8+ T细胞对IL-2敏感。本研究结果明确了IL-2与PD-1阻断在肿瘤免疫治疗中协同作用的潜在机制。研究证实,调控这些机制将为提高肿瘤免疫联合治疗的疗效提供新的策略。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41423-023-01086-x
https://www.nature.com/articles/s41422-023-00890-4
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录








还没有人评论,赶快抢个沙发