最新!北京大学王殊/梁静团队发文:揭示三阴性乳腺癌药物靶点和生物标志物
| 导读 | 以前的研究已经表明,ZNF652与CBFA2T3相互作用,并在体外抑制乳腺癌细胞的增殖。 |
10月30日,北京大学王殊/梁静团队在期刊《Cell Reports》上在线发表题为“PD-L1-mediated immune evasion in triple-negative breast cancer is linked to the loss of ZNF652”的研究论文,研究揭示了PD-L1的调控机制,并支持将ZNF652作为乳腺癌免疫治疗的潜在生物标志物和药物靶点。

https://www.cell.com/cell-reports/fulltext/S2211-1247(23)01355-4
研究背景
01
近年来,免疫检查点抑制剂(ICIs)的开发已经彻底改变了癌症治疗。在癌细胞利用的免疫逃逸机制中,程序性死亡配体-1(PD-L1)是一种I型跨膜蛋白,它与其受体PD-1结合,以抑制微环境中的T细胞活化。针对PD-L1-PD-1信号通路的拮抗抗体已被用于治疗多种恶性肿瘤,包括黑色素瘤、非小细胞肺癌、肾癌和乳腺癌等等。然而,克服内源性和获得性耐药仍然是提高抗PD-L1-PD-1治疗的响应率和持续时间的挑战。PD-L1-PD-1阻断疗法的有效性与多个参数有关,包括PD-L1阳性率、肿瘤突变负荷和某些转录标志。然而,在不同的癌症中,这些因素的可预测性各不相同。PD-L1-PD-1轴的调控机制需进一步研究。
PD-L1通常在造血细胞和血管内皮细胞中表达,但在许多类型的癌症中常常出现过表达。PD-L1的上调可以被炎症因子和多种致癌信号通路触发。最强效的诱导PD-L1表达的细胞因子是干扰素γ(IFN-γ),其作用主要通过JAK-STAT-IRF1信号通路。在非小细胞肺癌和三阴性乳腺癌中,也可以通过激活EGFR、MYC或YAP/TAZ等多种致癌信号通路来诱导PD-L1的上调表达。然而,PD-L1是否存在内在的抑制机制尚不清楚。
锌指蛋白652(ZNF652)是Krüppel C2H2型锌指蛋白家族的成员之一。ZNF652位于染色体17q21.3区域,该区域在多种癌症中频繁发生等位基因丧失(LOH),同时还包含了重要的肿瘤抑制基因TP53和BRCA1。以前的研究已经表明,ZNF652与CBFA2T3相互作用,并在体外抑制乳腺癌细胞的增殖。ZNF652的功能异常也与其他恶性肿瘤,如外阴癌和前列腺癌有关联。然而,ZNF652在肿瘤发生中的分子机制目前尚不清楚。
研究发现
02
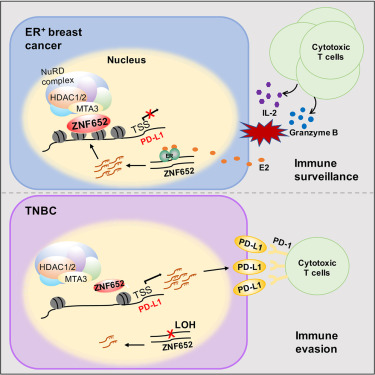
在研究中,研究人员报告了锌指蛋白652(ZNF652)是PD-L1的强效转录抑制因子。 ZNF652在各种癌症中经常发生等位基因丧失(LOH)。更高的LOH率和缺乏雌激素诱导的转录导致在三阴性乳腺癌(TNBC)中抑制了ZNF652的表达。在机制上,ZNF652与NuRD转录共抑制复合物物理上相互作用,以抑制一组基因,包括PD-L1。 ZNF652的过表达抑制了PD-L1的转录,而ZNF652的缺失则上调了PD-L1的表达。在三阴性乳腺癌中失去ZNF652会释放PD-L1介导的免疫逃逸,无论体外还是体内都能观察到这种现象。在乳腺癌进展过程中,ZNF652表达逐渐减少,低水平的ZNF652与PD-L1表达升高、浸润的CD8+T细胞较少以及三阴性乳腺癌预后不良相关。
ZNF652是乳腺癌细胞中
PD-L1的强效转录抑制因子
03
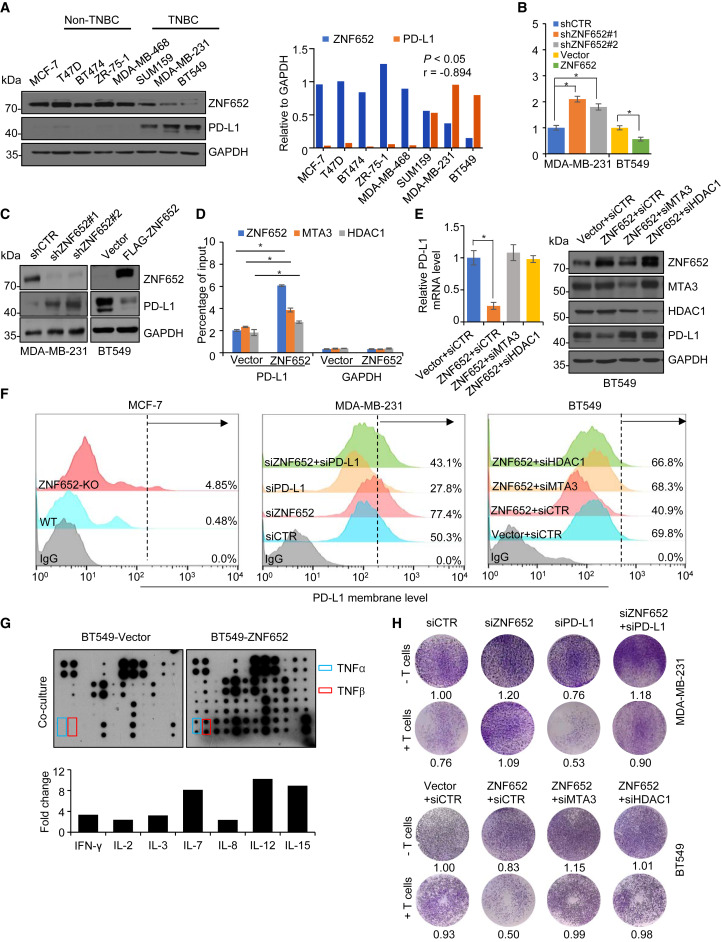
为了探究ZNF652-PD-L1轴在乳腺癌发生中的功能,研究人员首先收集了一系列BRCA细胞系,以检查ZNF652和PD-L1表达的相关性。免疫印迹显示所有ER+ BRCA细胞表达的ZNF652水平明显高于ER-细胞,并且PD-L1的表达与ZNF652呈负相关。与MCF-7细胞的结果一致,对MDA-MB-231细胞进行的RT-qPCR和免疫印迹分析也显示,在ZNF652敲除后,PD-L1明显上调。同时,在另一种ZNF652表达较低且转染效率较高的TNBC细胞系BT549中,外源性表达ZNF652显著降低了PD-L1的表达。重要的是,qChIP实验表明,在BT549细胞中ZNF652的过表达导致其在PD-L1启动子上的富集增加,以及NuRD成分MTA3和HDAC1的富集。
qRT-PCR和免疫印迹分析显示,使用特异性siRNA敲除MTA3或HDAC1完全消除了ZNF652介导的PD-L1转录抑制,支持NuRD复合物对ZNF652的抑制功能是必不可少的。IFN-γ是刺激PD-L1表达的主要细胞因子。为了检查ZNF652是否参与了IFN-γ刺激的PD-L1表达,研究人员用或不用IFN-γ处理稳定敲除ZNF652的MDA-MB-231细胞或稳定过表达ZNF652的BT549细胞。结果显示,尽管在存在或缺乏IFN-γ处理条件下敲除ZNF652都导致PD-L1的显著上调,但在这些条件下,上调程度相似。在BT549细胞中过表达ZNF652抑制了PD-L1的表达,但仍对IFN-γ处理产生响应。这些数据表明,ZNF652介导的基因抑制和IFN-γ介导的基因激活是通过不同的途径进行的。
为了证明ZNF652介导的PD-L1转录抑制在功能上具有相关性,研究人员接下来使用流式细胞术分析了ZNF652 KO MCF-7细胞、siZNF652处理的MDA-MB-231细胞、ZNF652过表达的BT549细胞及其相应对照中PD-L1在细胞膜上的水平。结果证实,ZNF652抑制了与细胞膜相关的PD-L1的表达,这主要通过与周围淋巴细胞上的PD-1结合,从而导致肿瘤细胞免疫逃逸。重要的是,在BT549细胞中敲除HDAC1或MTA3都消除了ZNF652过表达引起的PD-L1抑制作用,支持这些因子对于ZNF652的抑制功能是必需的。接下来,研究人员将对照的BT549细胞或过表达ZNF652的BT549细胞与活化的CD8+效应T细胞进行共培养。这些T细胞是从健康供体的外周血单个核细胞中分离出来的,并通过抗CD3 / CD28和IL-2处理进行活化。
使用RayBio人类细胞因子抗体芯片对这两种细胞群体的上清液进行了细胞因子分析。结果表明,ZNF652的过表达导致一系列细胞因子的显著增加,如IFN-γ、IL-2、IL-3、IL-7、IL-8、IL-12、IL-15、肿瘤坏死因子α(TNF-α)和TNF-β,表明共培养中T细胞活性增强。具体而言,研究人员在MDA-MB-231细胞中进行了ELISA实验,该细胞与活化的Jurkat T细胞共培养。结果显示,ZNF652的敲除抑制了Jurkat细胞的IL-2产生,同时PD-L1的同时敲除可以拯救这种作用。此外,通过活细胞计数评估T细胞杀伤活性发现,在MDA-MB-231细胞中敲除ZNF652导致T细胞杀伤活性降低,而同时敲除PD-L1则使其恢复正常。相反地,在BT549细胞中过表达ZNF652增强了T细胞的杀伤活性,而同时敲除HDAC1或MTA3则减轻了这种效应。综上所述,这些实验证明ZNF652抑制了体外乳腺癌细胞通过PD-L1介导的免疫逃逸。
研究结果
04
综上所述,研究揭示了PD-L1的调控机制,并支持将ZNF652作为乳腺癌免疫治疗的潜在生物标志物和药物靶点。(转化医学网360zhyx.com)
参考资料:
https://www.cell.com/cell-reports/fulltext/S2211-1247(23)01355-4
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发