CTM重要进展!华东理工大学三策联用实现对肿瘤细胞命运的精准靶向调控
| 导读 | 精准调控癌细胞中的部分关键蛋白分子表达,是治疗癌症和发现其相关分子机制的重要策略之一,但在实际研究和应用中具有一定的挑战性。目前广泛应用的基于CRISPR/Cas9的基因编辑技术和蛋白降解靶向嵌合体(PROTACs)技术在调控基因表达和蛋白质功能方面发挥了重要作用, 然而其靶向的准确性和可控性仍有待提高, 本研究巧妙设计和联合利用了纳米双抗、蓝光调控蛋白降解和癌细胞内基因靶向编辑3策略,实现了对癌细胞命运的精准靶向调控,为研发新型抗实体肿瘤生物药物奠定了重要基础。 |
近日,华东理工大学生物工程学院、生物反应器工程国家重点实验室马兴元教授团队,在《Clinical and Translational Medicine》(简称CTM)(中科院SCI分类1区、JCR分区Q1)上,在线发表了题为 “Split-Cas9-based targeted gene editing and nanobody-mediated proteolysis-targeting chimeras optogenetically coordinated regulation of Survivin to control the fate of cancer cells” 的原创性科研论文。该研究通过组合paCas9-GOI和paProtacL-POI系统实现蓝光可控抑制特异性基因表达,该方法不仅能够探究功能未知的蛋白质,还能够特异性抑制在癌症中高表达的蛋白质分子以此控制癌细胞的命运。

https://onlinelibrary.wiley.com/doi/10.1002/ctm2.1382
研究背景
01
多种关键蛋白分子在癌细胞的凋亡、增殖和迁移中发挥重要作用,并且与正常组织相比,这些蛋白也处于异常高表达状态。为了更好的研究这些蛋白分子的功能,抑制蛋白表达是一种有效策略。CRISPR/Cas9技术的出现和发展为研究特定基因的功能提供了一种有效的方法。虽然CRISPR/Cas9可以编辑靶基因,但它仍然没有直接编辑基因的蛋白产物,并且存在脱靶和遗传毒性等副作用。蛋白水解靶向嵌合体(PROTAC)是一种利用泛素-蛋白酶体系统降解靶蛋白的技术。它由E3泛素连接酶配体、靶蛋白配体和连接子三个特异性元件组成。通过与靶蛋白以及E3连接酶形成三元复合物,实现靶蛋白的多重泛素化,并使靶蛋白最终被蛋白酶体降解。虽然靶蛋白处于降解水平,但其基因在转录水平仍具有活性。尽管CRISPR/Cas9和PROTACs都有若干缺点,但协同使用两种系统分布靶向基因与蛋白,可导致靶蛋白表达的快速降低。同时,精准调控癌症中关键蛋白的表达对于肿瘤治疗和细胞命运至关重要。因此,建立一个可控的调控蛋白表达的方法迫在眉睫。与此同时,光具有低毒性、易获取、易操作、时空分辨率高等优点,可作为一种理想的诱导剂。Nihongaki等人开发了用于基因编辑的光激活Cas9(paCas9)系统,将完整的Cas9蛋白在空间上分成两部分,分别与在蓝光照射下可形成异源二聚体的nMag和pMag蛋白融合,从而将分裂的Cas9合为一,高效可控地发挥编辑功能。根据AsLov2的特性,可将E3连接酶的配体融合在Jα螺旋的C端,并通过蓝光调节配体的暴露与隐藏。因此,AsLov2可作为可控的“Linker”存在。Von Hippel-Lindau的配体称为VHLL,仅含有7个氨基酸的ALAPYIP,但能有效富集E3连接酶,且短配体易于被AsLov2的C端Jα螺旋隐藏。纳米抗体作为PROTACs的“弹头”,可以与靶蛋白有效的结合。这三种组分融合构建了光活化的PROTAC-Like(paProtacL)降解体系。通过引入纳米抗体,光敏蛋白,基因编辑,三策并举实现对肿瘤细胞命运的精准靶向调控。
研究进展
02
一方面,为了进行特定基因的可控编辑,选择光控split-Cas9方法进行基因编辑,并命名为paCas9-GOI。另一方面,选择纳米抗体、VHLL以及AsLov2来模拟PROTACs的形式,构建得到paProtacL-POI。将两种技术结合用于同一基因/蛋白以实现更大程度的抑制。其具体工作模式图如下图所示:
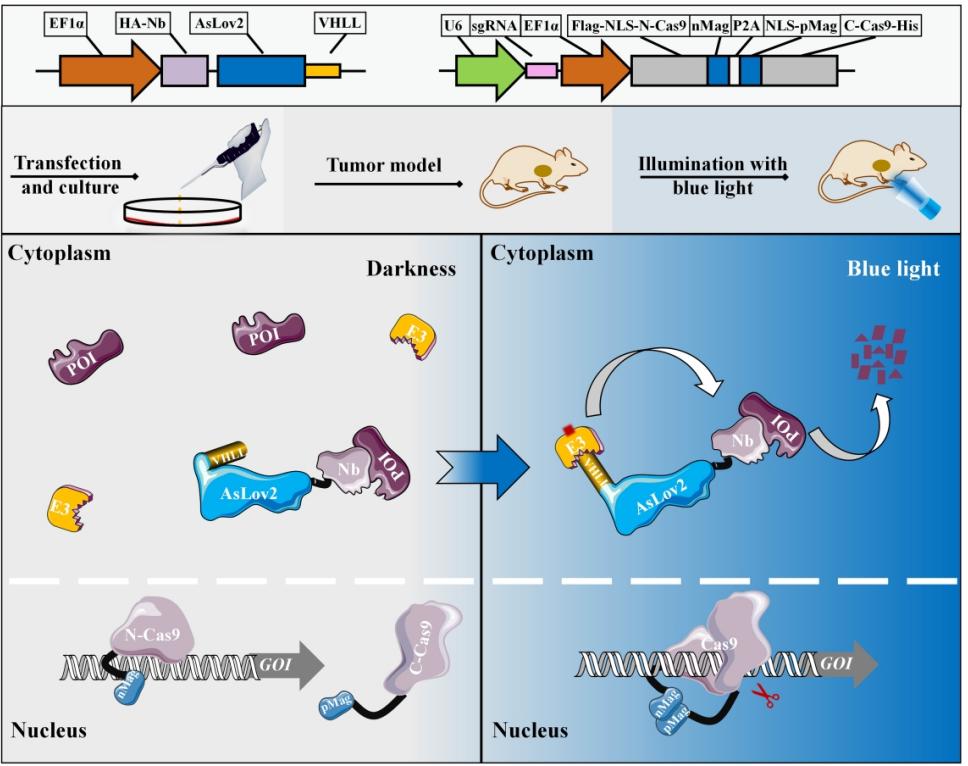
paProtacL-POI与paCas9-GOI组合以抑制靶蛋白表达的模式图
研究人员以EGFP蛋白为例,构建了稳定表达EGFP的UMUC-3-EGFP稳定转移细胞系。将两套包装好的慢病毒颗粒分别或者联合滴加进UMUC-3-EGFP细胞中。在光照48小时后发现paProtacL-EGFP与paCas9-EGFP均能够有效抑制EGFP蛋白的表达,且联合抑制效果更强。随后,为了验证这两套系统在癌症治疗中的作用,本研究选择Survivin蛋白,作为治疗靶点。已有研究表明,Survivin蛋白不仅发挥抗凋亡的功效,而且能够有效促进癌细胞的迁移与增殖。因此,下调Survivin蛋白的表达,能够抑制肿瘤细胞的生长。Nb4A是实验室筛选到的Survivin的纳米抗体,可与Survivin蛋白有效结合。将其替换到paProtacL-POI的骨架成分上,便获得了paProtacL-Survivin系统。该系统能够通过泛素-蛋白酶体途径有效的降解Survivin蛋白。同时,在paCas9-GOI系统中,引入高效的sgRNA序列,能够引导Cas9蛋白编辑Survivin基因,进而使Survivin蛋白的表达水平逐渐降低。当将双系统联合应用时,发现它们对Survivin蛋白的降解能力显著强于单一系统。紧接着,通过一系列体外实验证明了paProtacL-Survivin与paCas9-Survivin均能够有效的促进膀胱癌细胞UMUC-3与5637 的凋亡,抑制它们的增殖与迁移,并且联合应用效果更强。动物实验表明paProtacL-Survivin与paCas9-Survivin系统可以有效地抑制肿瘤生长,并且两者联合应用展现出更强的抑制能力。同时,HE和IHC结果表明,paProtacL-Survivin与paCas9-Survivin系统均能有效地降低Survivin蛋白的表达。Survivin蛋白的降低会导致Caspase-3蛋白的积累,进而促进癌细胞凋亡。同时,Ki-67蛋白的下调意味着肿瘤增殖能力的降低。此外,裸鼠心、肝、脾、肺、肾和胰腺的HE染色,没有出现明显的组织形态学变化。总体而言,动物研究表明,paProtacL-Survivin和paCas9-Survivin的组合比单独的paProtacL-Survivin或paCas9-Survivin系统减少Survivin蛋白和抑制肿瘤生长的能力更强。
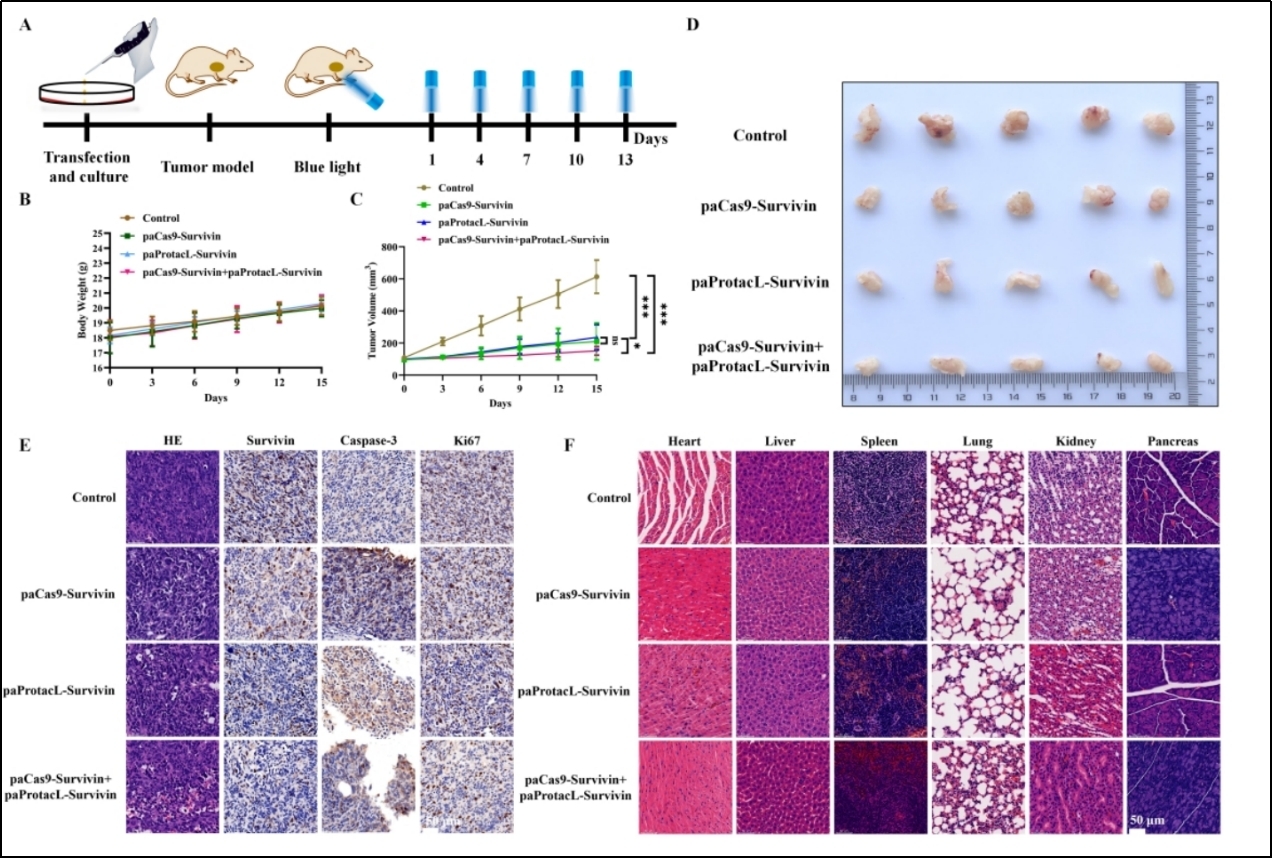
抑制Survivin表达促进UMUC-3和5637细胞的凋亡
研究意义
03
光控基因编辑和光诱导蛋白质降解系统在治疗人类疾病方面具有巨大潜力。该方法利用光诱导靶基因在转录和蛋白质水平上发生抑制功效,进而达到治疗效果。在这项研究中,我们组合了paProtacL和paCas9系统。发现它们比单独使用能够更有效地降低目的蛋白的表达水平,并且在体外联合应用更有效地促进膀胱癌细胞凋亡,抑制迁移和增殖。此外,动物研究结果证明了该系统的有效性和实用性,并且证明了降低Survivin蛋白的表达能够有效地抑制肿瘤生长。该系统的开发为研究功能未知的蛋白质提供了有效的策略,同时降低癌症中异常高表达的基因的表达水平,也可以实现治疗癌症的目的。
近20多年来,马兴元教授负责的生物药学与细胞工程研究室(BPCE-Lab),在肿瘤精准诊疗合成生物学、纳米抗体、新型疫苗生物制品及哺乳动物细胞系开发等方面取得了一系列研究成果,最新研究结果发表在Bioengineering & Translational Medicine(2021)、 Frontiers in Oncology(2021)、Pharmaceutics(2021)、NanoMed-NanoTechnol(2021)、Frontiers in Cell and Developmental Biology(2021)、Molecular Pharmaceutics(2020)、Nanoscale(2020)、Cancer Science(2020)、Frontiers in Pharmacology(2020)等国际知名杂志上。华东理工大学生物工程学院邓昌平博士研究生为该论文的第一作者。华东理工大学药学院郑文云教授为本文共同通讯作者。该研究得到了国家重点研发计划“合成生物学”专项、国家“新药创制”重大专项,和国家自然科学基金等项目的资助。(转化医学网360zhyx.com)
参考资料:
https://onlinelibrary.wiley.com/doi/10.1002/ctm2.1382
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发