厦门大学刘文教授团队发文揭示治疗病毒感染的新途径
| 导读 | 导读:模式识别受体介导的固有免疫在宿主抵御病毒感染中至关重要,越来越多的编码和非编码基因被发现编码微蛋白。然而,微蛋白在病毒感染反应中的分布和功能仍不明确。 |
近期,厦门大学刘文教授及李文娟在期刊《Science Advances》上发表了题为“MAVI1, an endoplasmic reticulum–localized microprotein, suppresses antiviral innate immune response by targeting MAVS on mitochondrion”的研究论文,本研究中,研究人员系统地鉴定了对水泡性口炎病毒感染有反应的微蛋白。一种保守的、定位于内质网的膜微蛋白MAVI1(抗病毒免疫微蛋白1)被发现与定位于线粒体的MAVS蛋白相互作用,并抑制MAVS聚集和I型干扰素信号的激活。一种靶向MAVI1和MAVS相互作用的肽抑制剂激活I型干扰素信号通路以防御病毒感染。本研究结果揭示了微蛋白在调节抗病毒固有免疫应答中发挥重要作用,靶向微蛋白可能是治疗病毒感染的一种治疗途径。

https://www.science.org/doi/10.1126/sciadv.adg7053#sec-3
研究背景
01
天然免疫作为机体抵御RNA、DNA病毒等病原微生物的第一道防线,可诱导机体产生强大的抗病毒反应。病毒感染病毒后,病毒来源的RNA/DNA会被模式识别受体识别,包括toll样受体(TLRs)、维甲酸诱导基因I (RIG-I)样受体(RLRs)、nod样受体、C型凝集素受体和其他几种核酸传感器。RNA感受器的TLR家族蛋白包括TLR3、TLR7和TLR8,主要定位于胞内体;RNA感受器的RLRs家族蛋白包括RIG-I、黑色素瘤分化相关蛋白5 (Melanoma differentiation-associated protein 5, MDA5)和遗传学与生理学实验室2 (Laboratory of genetics and physiology 2, LGP2),主要定位于细胞的细胞质。其中,TLR3以序列独立的方式识别双链RNA (dsRNA), TLR7和TLR8检测单链RNA。
随着2001年人类基因组初稿的完成,在接下来的十年中,注释的人类基因数量显著增加。它推动了一个阐明基因组非编码部分功能的时代。在2000年代中期,他们对蛋白质编码基因的搜索数量约为2万,这远远被低估了。随着核糖体分析(Ribo-seq)和质谱分析(MS)技术的发展,以前被认为是非编码的各种RNA转录本,包括微小RNA (microRNA)、环状RNA (circRNA)、核小RNA (snRNA)、与piwi相互作用的RNA和长链非编码RNA (lncRNA),已经被证明可以编码短肽或蛋白质。lncRNA编码的蛋白质参与发育、代谢、钙稳态、RNA脱帽、应激信号传导、细胞死亡和肿瘤发生等多种生物学过程。微蛋白(尤其是定位于膜的微蛋白)是否参与rlr - mavs介导的抗病毒免疫应答仍未明确。
研究过程及发现
02
在HEK293细胞中进行转录组学和核糖核酸序列分析,研究发现超过800种来自编码和非编码基因的微蛋白对VSV病毒感染有潜在的反应。其中739个微蛋白为新生微蛋白,有待进一步的实验验证。在已知的77种微蛋白中,膜微蛋白高度富集。据报道,约30%的微蛋白含有α TM结构域,这一比例明显高于蛋白质组中的蛋白,表明微蛋白具有生物膜富集的倾向。膜微蛋白参与内质网应激反应、肌肉发育和抗病毒免疫反应。其中一个微蛋白,研究人员将其命名为MAVI1,被发现是ER TM蛋白。MAVI1过去被认为是一种lncRNA,其RNA形式在癌症发展中起作用。然而,它在I型IFN信号传导和抗病毒免疫反应中的功能在很大程度上依赖于它的蛋白产物。MAVI1直接靶向线粒体上的MAVS,干扰其与RNA传感器蛋白RIG-I的相互作用。据报道,乳酸通过结合MAVS中的TM结构域抑制MAVS/RIG-1相互作用和MAVS聚集。其作用机制是乳酸引起线粒体内MAVS定位的改变。然而,研究结果表明,MAVI1对MAVS的定位没有明显的影响。mav1抑制RIG-I和MAVS相互作用的潜在分子机制尚不清楚,这将是一个意义的问题。不同细胞器之间的接触已被证明在多种细胞过程中具有重要的功能,如线粒体细胞色素c氧化酶的合成、Ca2+信号的传递、高尔基Ca2+梯度的形成以及磷酸脂和鞘糖脂的合成。内质网和线粒体之间的接触区域,即MAM,是Vance在几十年前分离并鉴定出来的。此外,MAM还参与多种生物功能,如磷脂合成、细胞器介导的炎症、钙稳态、自噬和线粒体裂变。除研究人员筛选的MAVI1外,其余膜微蛋白在抗病毒免疫中的作用值得进一步研究。例如,CCDC167被报道为细胞周期的调节因子,并作为乳腺癌的潜在治疗靶点。小细胞粘附糖蛋白(SMAGP)被报道为宫颈癌发生和进展的生物标志物。
如上所述,MAVI1的ER定位及其与MAVS的相互作用对于抑制I型IFN信号传导和抗病毒固有免疫应答至关重要。研究人员设计了一种肽抑制剂(Pi),可以干扰mav1和MAVS之间的相互作用,从而激活I型IFN和ISG的表达,防御病毒感染。未来的研究需要进一步提高PiMAVI1的特异性和有效性,如将疏水性非临界氨基酸Leu替换为Ala以提高其溶解度,从两端缩短以提高其稳定性。
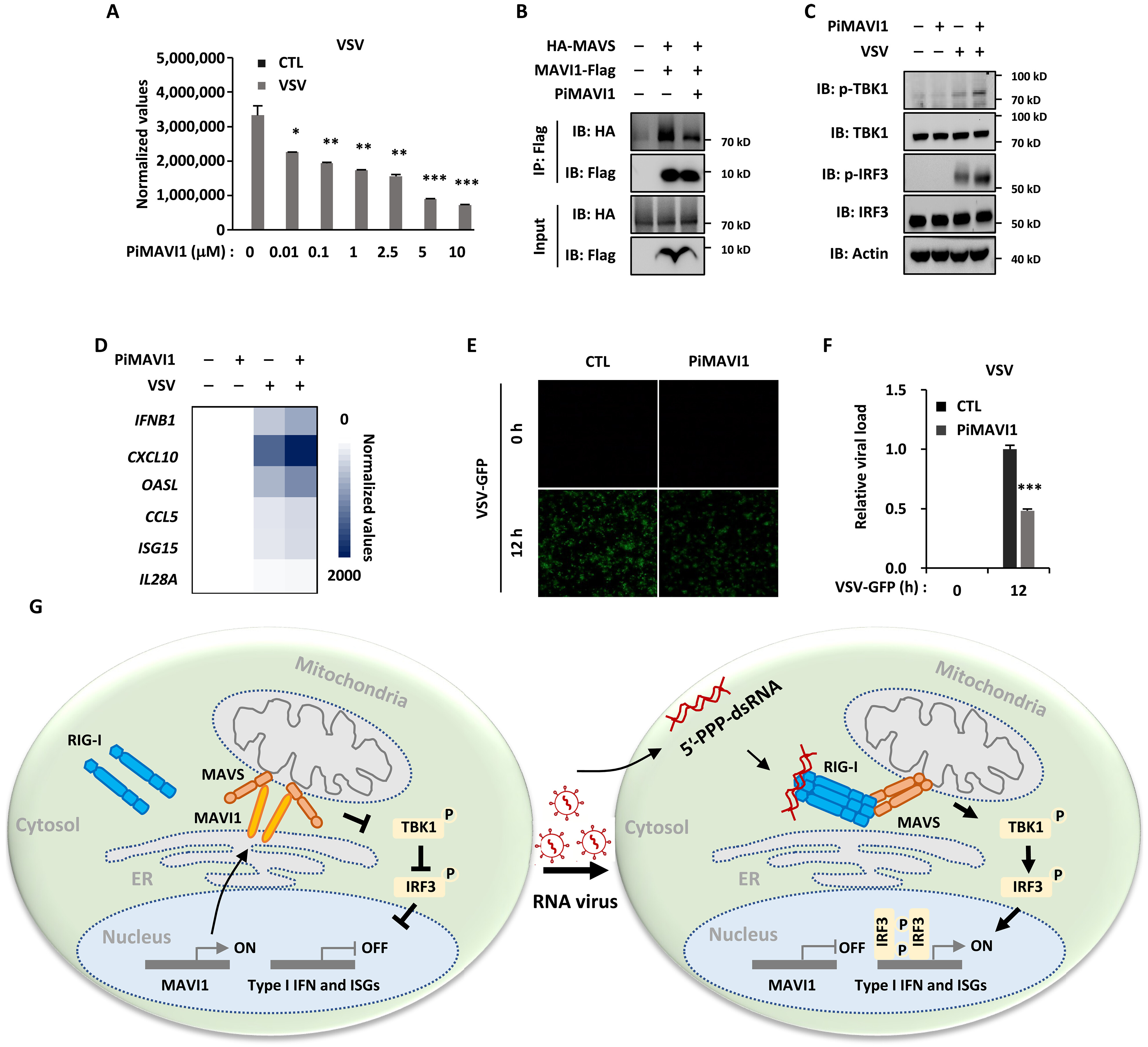
靶向MAV1和MAVS相互作用的肽抑制剂(PiMAVI1)在激活I型IFN信号传导和抗病毒免疫应答方面具有强效作用
研究意义
03
综上所述,ER TM微蛋白MAVI1靶向MAVS抑制宿主细胞的I型IFN信号传导和抗病毒免疫应答。病毒感染后,mav1表达下调,导致mavs介导的抗病毒免疫应答激活。针对mav1和MAVS相互作用的肽抑制剂(PiMAVI1)在激活宿主抗病毒免疫和防御病毒感染中具有重要作用。本研究揭示了微蛋白可能是一类抗病毒固有免疫的药物靶点,PiMAVI1可能是治疗I型IFN信号通路相关疾病的潜在治疗途径。(转化医学网360zhyx.com)
参考资料:
https://www.science.org/doi/10.1126/sciadv.adg7053#sec-3
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发