重大突破!中南大学合作发现阻止肝癌生长、迁移和侵袭的分子机制 揭示治疗新靶点
| 导读 | 导读:尽管越来越多的证据表明miR-297有助于肿瘤的发生和进展,但miR-297在肝细胞癌(HCC)中的作用及其潜在的分子机制仍不清楚。 |
近日,中南大学/中信湘雅生殖遗传医院/国家人类干细胞工程研究中心研究人员在国际权威期刊《Cell Death&Disease》上发表了题为”MiR-297 inhibits tumour progression of liver cancer by targeting PTBP3”的研究论文, 该研究中,研究人员报道了人羊膜上皮细胞(hAECs)条件培养基处理后,miR-297在hepG2细胞中的表达显著增加,可以抑制hepG2的增殖和迁移。而过表达miR-297在体外可抑制HCC细胞系的细胞增殖、迁移和侵袭,在体内可抑制HCC的发生。聚嘧啶轨道结合蛋白3 (PTBP3)在HCC细胞系中被鉴定为miR-297的直接靶基因,并介导miR-297在HCC细胞中的功能。此外,体外细胞实验证实,过表达miR-297可通过下调PTBP3表达抑制PI3K/AKT信号通路,从而抑制HCC细胞的增殖、迁移和侵袭。综上所述,研究结果表明,miR-297可以下调PTBP3的表达,抑制PI3K/AKT信号通路的激活,从而阻止HCC的生长、迁移和侵袭。

https://www.nature.com/articles/s41419-023-06097-0#Sec26
研究背景
01
肝癌是世界上第六大最常见的恶性肿瘤和第四大最常见的癌症相关死亡原因,仅在中国每年就占病例和死亡总数的50%左右。肝细胞癌(HCC)占原发性肝癌病例的75%-85%,其特点是预后差,死亡率高。尽管最近手术技术的进步和5年生存率的提高,但由于肝内复发和转移率高,HCC患者的长期预后仍然很差。因此,迫切需要阐明HCC发生和发展的分子机制,以便更好地治疗。人羊膜上皮细胞(hAECs)是一种来源于胎膜的人胎盘成体干细胞,是一种潜在的细胞治疗和组织再生的新细胞来源。越来越多的证据证明了haec的抗肿瘤特性。在本研究中,研究人员证明了人羊膜上皮细胞(hAECs)条件培养基的处理可以抑制hepG2的增殖和迁移。然而,haec抗肿瘤作用的分子机制尚不清楚。
为了确定生长抑制的机制,研究人员进行了miRNA阵列筛选miRNA的差异表达。研究人员证明,在人羊膜上皮细胞(hAECs)条件培养基处理后,miR-297在HepG2细胞中的表达显著增加。MicroRNAs (miRNAs)是一组内源性进化保守的单链非编码小RNA, miRNA作为基因表达的转录后调控因子,广泛参与癌症的发生、发展和进展过程,如细胞增殖、凋亡、转移和耐药等,从而抑制或促进癌症的发展。最近,miR-297被发现参与肿瘤的发展。研究表明,与正常肝组织相比,miR-297在HCC组织中的表达明显降低。然而,miR-297在肝癌中的作用及其潜在机制尚不清楚。由于miR-297在肝癌中的肿瘤抑制作用与其在结直肠癌、肺腺癌和胶质母细胞瘤等其他类型癌症中的肿瘤促进作用形成对比,因此研究人员进一步研究了miR-297对肝癌肿瘤进展的影响。
研究过程及发现
02
在本研究中,研究人员证明了miR-297在体外抑制HepG2和Huh7细胞的增殖和G1/S细胞周期转变。它还能抑制肝癌细胞的侵袭和迁移。根据miR-297在体外对肝癌的作用,研究人员对HepG2细胞进行了体内成瘤实验,发现miR-297在体内也抑制了HepG2细胞的致瘤性。这些结果表明miR-297在肝癌中具有潜在的肿瘤抑制作用。
在临床样本中,miR-297水平在癌组织中比在非癌组织中有降低的趋势。这与以往研究发现HCC患者组织中miR-297的表达较正常肝组织明显降低一致。为了确认miR-297的表达是否与p53的表达相关,研究人员根据p53的表达水平将70例肝癌患者样本分为p53阳性(1-12)组和p53阴性(0)组。
多嘧啶束结合蛋白3 (PTBP3)在选择性剪接(AS)调控、成熟、转运、翻译、RNA衰变、储存和转换等转录后调控中起关键作用。PTBP3在乳腺浸润性癌、结肠腺癌、肝细胞癌等肿瘤中均有高表达。虽然PTBP3在人类各种肿瘤中的作用已被探索,但PTBP3在肝细胞癌中的分子功能和机制尚缺乏。最近的研究表明,PTBP3通过调节ZEB1 mRNA的稳定性促进乳腺癌的上皮-间质转化。研究人员证实PTBP3可促进MKN45人胃癌细胞增殖并抑制其分化。本研究通过双荧光素酶报告基因实验确定了PTBP3是miR-297在肝癌中的直接靶基因,并通过细胞功能实验研究了PTBP3敲低对HepG2细胞的影响。结果表明,PTBP3的降低抑制了HepG2细胞的生长、迁移和侵袭,PTBP3的过表达恢复了miR-297过表达对HepG2细胞进展的抑制作用。
其他研究发现,胃癌细胞中PTBP3的下调抑制了Akt的磷酸化,Akt也被证明参与了HCC的生长和转移。多项研究报道了PI3K/AKT信号通路与HCC之间的密切联系,抑制该通路可能是一种可行的HCC治疗方法。研究人员还发现miR-297过表达通过PTBP3抑制PI3K/AKT信号通路,从而抑制HCC细胞的增殖、侵袭、集落形成和迁移。敲低PTBP3抑制HepG2细胞的生长和转移,过表达PTBP3恢复了miR-297过表达对细胞进展的抑制作用。最近的研究将PTBP3定义为EMT的调节剂,通过控制ZEB1的表达起作用,这在乳腺肿瘤细胞中确立了PTBP3的致癌功能。在本研究中,PTBP3支持EMT转录程序的正常功能,下调上皮标志物(E-cadherin),但上调间质标志物(Vimentin和N-cadherin)。MiR-297过表达诱导PTBP3表达降低,从而抑制肝癌细胞类似EMT过程。
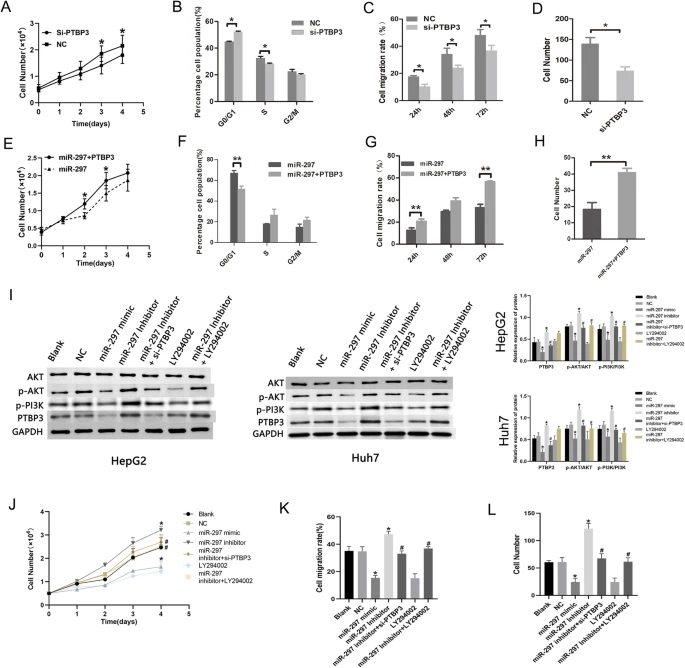
PTBP3表达降低可阻断PI3K/AKT信号通路,抑制HCC细胞的增殖、迁移和侵袭
研究意义
03
在本研究中,研究人员证明过表达miR-297在体外抑制肝癌细胞的增殖、迁移和侵袭,在体内抑制肝癌细胞的肿瘤发生。研究人员在肝癌细胞中发现PTBP3是miR-297的直接靶基因。Mir-297可直接靶向PTBP3,失活PI3K/AKT信号通路,抑制HCC细胞系的生长、迁移和侵袭。因此,miR-297可能是一个有效的潜在肝癌治疗靶点。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41419-023-06097-0#Sec26
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录







还没有人评论,赶快抢个沙发