最新!暨南大学研究发现促进结直肠癌肝转移的最新机制
| 导读 | 血源性转移是结直肠癌肝转移(CRCLM)的主要途径。然而,作为肿瘤血管中的守门人,TPC在血源性转移中的作用在很大程度上仍然未知,这可能是由于缺乏用于TPC分离的特异性生物标志物。 |
8月27日,暨南大学张冬梅、叶文才和陈敏锋联合在《Advanced Science》上发表研究论文“TCAF2 in Pericytes Promotes Colorectal Cancer Liver Metastasis via Inhibiting Cold-Sensing TRPM8 Channel”,研究从冷感觉受体的角度揭示了TPCs先前未发现的促转移作用,为CRCLM提供了有希望的诊断生物标志物和治疗靶点。

https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202302717
研究背景
肝转移是结直肠癌(CRC)患者疾病相关死亡的主要原因,鉴定潜在的生物标志物对于结直肠癌肝转移(CRCLM)的诊断和治疗具有重要意义。血源性播散是CRCLM的原发性转移事件,其间肿瘤细胞从原发肿瘤内渗出的特征是肿瘤细胞穿透血管内皮壁进入脉管系统,引发转移级联反应。因此,确定肿瘤细胞内渗的潜在机制可能有助于制定诊断和治疗肿瘤转移的有效策略。目前对肿瘤内渗的研究主要集中在肿瘤细胞与内皮细胞之间的相互作用上。肿瘤周细胞(TPC)是嵌入血管腔外的重要血管成分,是肿瘤血管的守门人。然而,TPCs对肿瘤细胞内渗的调节作用在很大程度上尚不清楚,并且没有TPC相关分子标志物作为CRCLM生物标志物的报道。
目前,大多数研究都集中在细胞表面受体的表达和功能上,例如CD248、PDGFRβ、整合素、分泌细胞因子和代谢酶在 TPC 中。然而,离子通道蛋白及其伴侣蛋白在TPCs中的表达和调控作用尚未阐明。TRP 通道相关因子2(TCAF2)是瞬时受体电位阳离子通道亚家族 M 成员8(TRPM8)的伴侣蛋白,后者是调节人体组织中对寒冷适应反应的主要冷传感器。迄今为止,很少有研究评估TCAF2在癌症中的作用。TCAF2是一种缺氧相关基因,在肺癌和乳腺癌中具有未知的功能。TCAF2与TRPM8结合,促进其向细胞表面的运输并抑制其离子通道活性,从而增加前列腺癌细胞在体外的迁移。然而,TCAF2在TPC中的作用及其对癌症发展的调节作用在很大程度上仍然未知。
研究进展
为了确定TPCs在结直肠癌肝转移中的作用,从有或没有肝转移的CRC患者中分离的TPC分别命名为TPCLM和TPCNM。我们发现TPCNM和TPCLM表达相同水平的PC标记,并表现出相似的增殖和迁移能力。然而,与TPCNM相比,TPCLM的条件培养基显著促进了迁移和EMT的各种CRC细胞,包括HCT116,DLD-1,SW480和SW620细胞,表明TPCLM对CRCLM具有深远的促转移作用。
为了进一步研究TPCLM促转移作用的机制,我们对TPCNM和TPCLM进行了基于串联质量标签(TMT)的定量蛋白质组学分析。鉴定出大约214种差异表达的蛋白质。其中,102种蛋白在TPCLM中上调。基因集富集分析(GSEA)显示,与TPCLM相比,与阳离子稳态相关的基因在TPCNM中显著富集。然而,阳离子稳态在TPCs中的作用尚不清楚。引人注目的是,TCAF2作为TRPM8离子通道的结合蛋白,与TPCNM中的蛋白相比,是TPCLM中表达第二高的蛋白,这已通过定量实时PCR和蛋白质印迹。此外,我们发现来自肝转移的CRC患者的肿瘤组织中TCAF2 TPC比率增加。然而,TCAF2在CRC患者肝转移结节的TPC中检测不到。进行ROC曲线分析以获得TCAF2 TPC比值的最佳临界值,该临界值确定为30%,用于预测具有较高灵敏度和特异性的CRCLM。TCAF2 TPC比值高(>30%)的患者表现出更差的OS和DFS。在肺转移乳腺癌患者的原发性肿瘤切片中观察到类似的结果。这些数据表明,TPC中的TCAF2可以作为肿瘤转移的预测生物标志物。
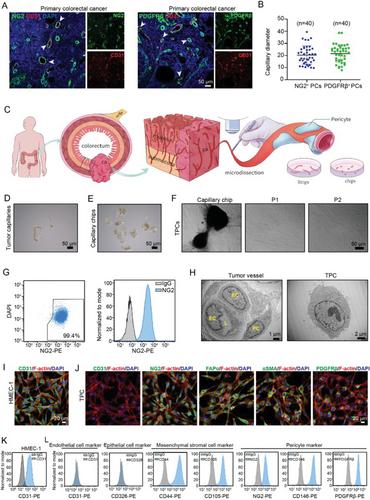
TCAF2在TPC中高度表达,并与CRCLM相关。
研究结论
本研究,我们开发了一种称为显微切割的新方法,结合基于周细胞培养基的方法(MPMA),以成功地从CRC患者手术切除的原发性肿瘤组织中获得TPC。蛋白质组学分析显示,TCAF2在CRCLM患者的TPC中过表达,其在TPC中的表达与延长总生存期(OS)和无病生存期(DFS)呈负相关。Tcaf2的周细胞特异性缺失抑制CRC细胞上皮—间充质转化(EMT)并抑制肿瘤转移。TPC中的TCAF2抑制TRPM8的表达和离子通道活性,通过激活Wnt5a/STAT3信号通路促进肿瘤细胞EMT和转移。薄荷醇是TRPM8通道的激动剂,通过抑制Wnt5a分泌显著抑制CRCLM。我们的数据表明,TCAF2和TRPM8是有希望的CRCLM的预测生物标志物和治疗靶点。
总之,这项研究提供了一种从实体瘤中分离TPCs的替代方案。更重要的是,本研究首先揭示了血源性转移过程中TPC中冷感受体及其相关因子的功能和机制,揭示了血源性肿瘤转移的潜在TPC相关诊断和治疗靶点。(转化医学网360zhyx.com)
参考资料:
https://onlinelibrary.wiley.com/doi/full/10.1002/advs.202302717
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录








还没有人评论,赶快抢个沙发