重大进展!北京协和团队阐明肿瘤相关巨噬细胞促进胃癌的作用机制
| 导读 | 作为一种恶性胃肠道肿瘤,胃癌(GC)的发病率和死亡率在世界范围内逐渐增加。GC的发生和发展是一个复杂、多步骤和多因素的过程。TAM的极化是GC TME的重要组成部分,受到多种信号通路和周围细胞的影响。 |
8月22日,中国医学科学院北京协和医院康维明教授团队在《Clinical and Translational Medicine》上发表了题为“Tumour-associated macrophages in gastric cancer: From function and mechanism to application”的综述论文,探讨了TAMs在GC进展中的不同功能和机制,包括表型亚型的转化;促进肿瘤增殖、侵袭和迁移;诱导化学耐药性;促进血管生成;免疫抑制的调节;代谢重编程;总结了与微生物群落的相互作用。

https://onlinelibrary.wiley.com/doi/full/10.1002/ctm2.1386
TAMS 起源和表型极化
巨噬细胞是先天免疫系统的特化、长寿命吞噬细胞,也是感染的第一反应者。巨噬细胞存在于大多数组织中,它们不仅启动对病原体的免疫反应和炎症反应,而且在调节组织稳态和组织修复和重塑中起关键作用。
巨噬细胞根据激活后的功能和作用可分为两种亚型:经典活化的M1巨噬细胞和交替活化的M2巨噬细胞。M1巨噬细胞主要通过自然和适应性免疫反应在1型辅助性T(Th1)细胞募集,病原体抵抗和肿瘤杀伤中发挥功能。此外,M1巨噬细胞通常由病原体,脂多糖,GM-CSF,肿瘤坏死因子-α(TNF-α),Th1细胞因子和干扰素-γ(IFN-γ)诱导。M2巨噬细胞通常由寄生虫或真菌,免疫复合物,凋亡细胞,巨噬细胞集落刺激因子(M-CSF),IL-13,TGF-β和Th2细胞激活。M2巨噬细胞的四种亚型基于它们不同的刺激:M2a(由IL-4和IL-13激活),M2b(由免疫复合物,Toll样受体配体和IL-1β激活),M2c(由糖皮质激素,IL-10和TGF-β激活)和M2d(由IL-6和腺苷激活)。值得注意的是,M1和M2极化态不是一成不变的,可以相互转化,因此它们可以用作GC免疫治疗的潜在靶标。
TME中TAMS与不同细胞类型的相互作用
TME的组成部分多种多样且复杂。肿瘤细胞周围的所有非恶性间充质细胞,如成纤维细胞、平滑肌细胞、内皮细胞和各种免疫细胞,相互作用并共同影响肿瘤进展。TAM通过分泌细胞外囊泡(EV)、细胞因子、趋化因子和蛋白质(包括肿瘤细胞、T细胞、血管内皮细胞(VECs)、癌症相关成纤维细胞(CAF)和间充质干细胞(MSCs))与TME中不同类型的细胞相互作用,从而促进GC进展。如图1所示,累积研究表明,肿瘤细胞可以通过分泌不同的交流介质来影响TAM的主要类型,然后构建最适合肿瘤细胞进展的微环境。
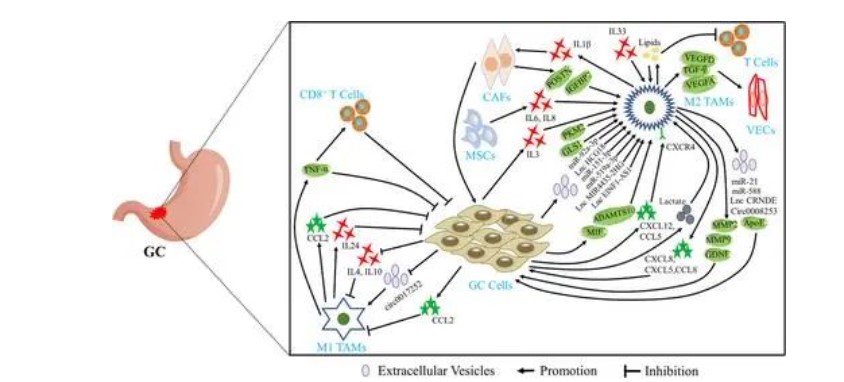
肿瘤相关巨噬细胞(TAM)与胃癌(GC)肿瘤微环境(TME)中的不同类型的细胞相互作用。
TAM在GC中的作用和机制
巨噬细胞在人体胃肠道中含量丰富,在病原体清除、调节炎症反应和胰岛素敏感性以及维持体内平衡方面起关键作用。当被外部刺激激活时,巨噬细胞将单核细胞从循环系统募集到肿瘤部位,并将它们极化成TAM。TAM通过外泌体或细胞因子的分泌物与肿瘤细胞相互作用,以促进肿瘤细胞的增殖,侵袭,迁移能力和血管生成。此外,TAMs通过分泌趋化因子触发调节性T细胞,抑制T细胞的抗肿瘤反应,破坏免疫细胞的相互作用,最终导致GC肿瘤细胞的免疫逃避。此外,TAM还通过代谢重编程和与微生物的相互作用在GC中发挥作用(图2)。
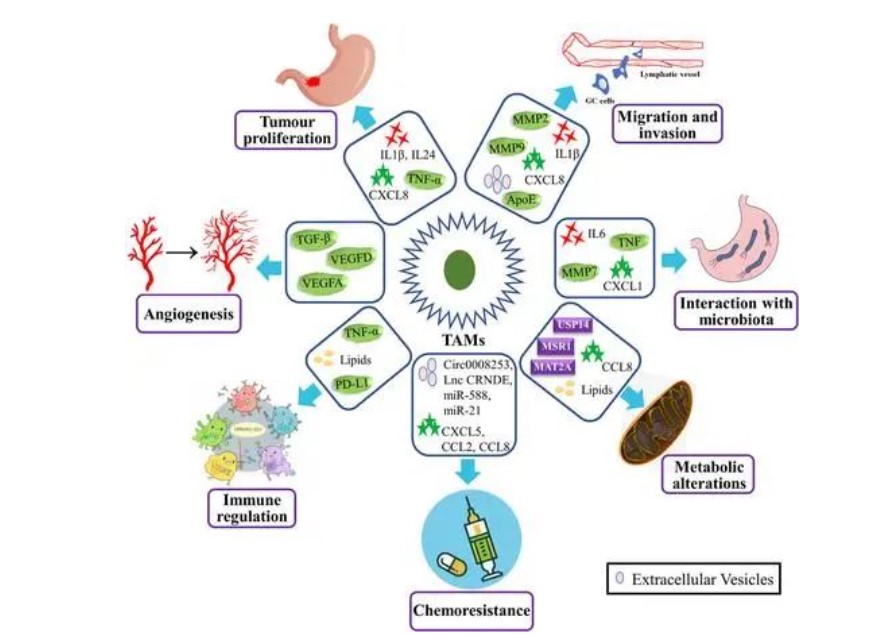
肿瘤相关巨噬细胞 (TAM) 通过刺激肿瘤相关血管生成来促进胃癌 (GC) 进展;促进细胞增殖、侵袭和转移;抑制抗肿瘤免疫反应;赋予化学抗性;调节新陈代谢;并与胃中的微生物群相互作用。
GC中TAM表型极化的调控
由于肿瘤通常始于上皮基质的慢性炎症环境,因此活化的巨噬细胞在肿瘤发生的早期阶段占主导地位,通过与其他免疫细胞产生活性氧和氮物种来触发邻近上皮的癌基因。肿瘤发生后,更多的循环单核细胞被募集到肿瘤部位,并通过分泌各种趋化因子(如CCL2,CCL5,VEGF和TGF-β)促进肿瘤进展。抑制核因子-κB(NF-κB)通过促进促炎细胞因子的转录和减少IL-1和IL-4的分泌诱导TAM的M10极化,而NF-κB的活化增强了M2 TAM的极化。同样,靶向STAT途径降低了巨噬细胞TAM的M2极化,59、60激活JAK2/STAT3通路通过增加IL-2和IL-6的分泌促进M8 TAM的极化。累积研究报告称,含有microRNA、环状RNA、长链非编码RNA(lncRNA)或源自GC细胞的蛋白质的EV调节巨噬细胞内化后TAM的极化。值得注意的是,从植物中提取的天然化合物,如黄伏卡瓦因B,索普里定,薯蓣美丁,埃利安颗粒和白桦酸,被发现可以增强M1 TAM的极化。此外,研究发现戊曲辛-3通过抑制GC细胞中JNK2 / 4的磷酸化来减少分泌IL-10和IL-1的细胞,从而抑制M2 TAM的极化。IL-4是一种细胞因子,被广泛报道可引起M2极化,而Zhao和Liu证明IL-4刺激的肝素结合-表皮生长因子(HB-EGF)依赖性EGFR反式激活抑制了IL-2刺激的STAT4激活诱导的M6 TAM的极化。此外,MMP7还显著抑制了M1 TAMs在胃损伤中的极化和癌前病变的发展。GC中M1 TAM的表型极化的调控网络如图3所示。
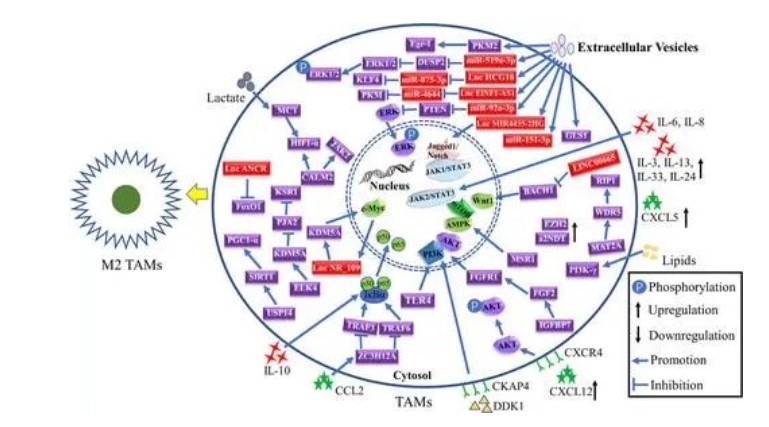
肿瘤相关巨噬细胞(TAM)的调节机制在胃癌中极化为经典激活的M1(促炎)巨噬细胞。
多项研究表明,TUBA1A、ELK3、GKN2、COL1A2、RAI14、KIF23、GHRL、KCND2、SERPINE1、COL5A2、ALDOC 和 SLC38A2 的高表达以及 GC 中 CD155 和 AKR1B10 的低表达表明使用公共数据库的数据在 TME 中的 M2 TAM 浸润较高。此外,TAMs通过增加细胞外脂质的摄取来提高PI3K-γ的表达,从而诱导M2表型极化。GC细胞的特征是增强糖酵解,产生大量乳酸,可以通过激活巨噬细胞中的单羧酸通道转运蛋白-缺氧诱导因子2亚基α(MCT-HIF1α)轴来诱导M1 TAM的极化。同样,据报道,空泡ATP酶的a2亚型的N末端结构域协同诱导TAM与M-CSF的极化。小鼠前胃癌细胞通过增加TGF-β2的分泌诱导M1 TAM的极化。GC中M2 TAM极化的具体调控网络如图4所示。
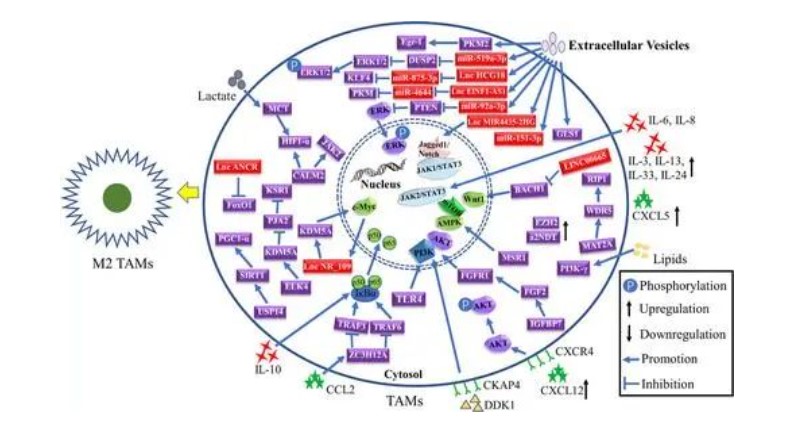
肿瘤相关巨噬细胞(TAM)的调节机制在胃癌中极化为经典激活的替代激活的M2(抗炎)巨噬细胞。
总之,本文综述了TAMs的表型极化、TAMs与TME中不同细胞类型的相互作用以及TAMs在GC中的潜在功能和机制。此外,它还回顾了如何将这些功能和机制用作GC患者的预后生物标志物以及GC治疗选择的潜在靶点。(转化医学网360zhyx.com)
参考资料:
https://onlinelibrary.wiley.com/doi/full/10.1002/ctm2.1386
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发