重大突破!海军军医大学/中国科学院/中国科学院大学/上海科技大学发现化疗耐药胰腺癌的治疗新靶点
| 导读 | 本研究为胰腺导管腺癌患者提供了有前景的药物治疗策略。 |
近日,海军军医大学/中国科学院/中国科学院大学/上海科技大学研究人员在权威期刊《Cell Reports Medicine》上发表了题为”Metabolic classification suggests the GLUT1/ALDOB/G6PD axis as a therapeutic target in chemotherapy-resistant pancreatic cancer”的研究论文,该研究描述了PDAC类器官的代谢组学特征,并将其分为葡萄糖-PDAC(高糖代谢水平)和脂质体-PDAC(高脂代谢水平)。葡萄糖型PDAC较脂类PDAC对化疗更耐药,且葡萄糖型PDAC患者预后更差。综合分析发现GLUT1/醛固酮酶B (ALDOB)/葡萄糖-6-磷酸脱氢酶(G6PD)轴通过重塑糖代谢诱导葡萄糖- PDAC的化疗抵抗。GLUT1高表达和ALDOB低表达的葡萄糖- PDAC中糖酵解通量、G6PD活性和嘧啶生物合成增加,这些表型可以通过抑制GLUT1表达或增加ALDOB表达来逆转。药理抑制GLUT1或G6PD可增强葡萄糖- PDAC的化疗反应。本研究发现揭示了与化疗敏感性差异相关的潜在代谢异质性,并通过化疗联合GLUT1/ALDOB/G6PD轴抑制剂为化疗耐药的葡萄糖-PDAC患者提供了有前景的药物治疗策略。

https://doi.org/10.1016/j.xcrm.2023.101162
研究背景
01
胰腺导管腺癌(PDAC)是最致命的恶性肿瘤之一,5年生存率仅为11%。化疗可以显著延长PDAC患者的生存期,但由于耐药机制复杂且不明确,PDAC患者的化疗应答率仍然较低。尽管许多研究都集中在基于基因组和转录组标签的PDAC分类上,目前定义的PDAC标签不能提示化疗敏感性或指导治疗决策。代谢重编程被认为是一种新兴的治疗耐药机制,为癌症治疗提供了机会。然而,由于丰富的间质细胞的存在,很少有研究探讨PDAC的代谢失调和异质性,使精确捕获肿瘤特异性代谢信息变得困难。因此,系统地描述PDAC的代谢和基因组特征可能揭示化疗敏感性的潜在分子细节,并有助于开发预防或逆转化疗耐药的靶向治疗。
由于代谢改变是癌症的标志之一,因此人们对代谢(特别是葡萄糖代谢)与PDAC起始、进展和治疗抵抗之间的关系越来越感兴趣。先前的研究在PDAC细胞系中进行,这些细胞系在糖酵解、脂肪生成和氧化还原途径中具有不同的代谢物水平,这些代谢物对多种代谢抑制剂表现出不同的敏感性。此外,在单个PDAC肿瘤内的代谢异质性已被确定与OXPHOS抑制剂的治疗耐药有关。根据糖酵解和胆固醇生成基因的中位标准化表达,研究人员确定了4种代谢表达亚型,并且糖酵解肿瘤与中位生存期最短相关。这些研究强调了需要表征代谢特征,并确定PDAC细胞生存和化疗耐药的关键通路,这可能为治疗提供了一个窗口。
研究过程及发现
02
虽然化疗显著延长了PDAC患者的生存期,但PDAC的化疗应答率仍然较低。迫切需要一种有效的分类策略,将患者分为敏感组和耐药组。基于代谢组学特征,研究人员将PDAC患者分为葡萄糖-PDAC组和脂质体-PDAC组,确定葡萄糖-PDAC为化疗耐药组,并开发了一种潜在的药物策略,包括抑制GLUT1/ALDOB/G6PD轴以增强葡萄糖-PDAC的化疗敏感性。
研究人员通过分析患者来源的PDAC类器官,成功确定了代谢亚型,并将其分为葡萄糖-PDAC和脂质体-PDAC。Glucomet-PDAC类器官通过重塑糖代谢对化疗产生抵抗。重要的是,葡萄糖- PDAC基因表达标签GLUT1/ALDOB可以有效地鉴别出总生存期最好和最差的患者。本研究提供了一个代谢重编程作为PDAC化疗耐药机制的例子,并确定了预测化疗反应的标志物。
研究结果表明单独的hENT1表达可能不足以预测GEM的敏感性。糖酵解通量增加已被确定为胰腺癌对GEM耐药的普遍机制。HIF -1α介导的代谢重编程提高了脱氧胞苷三磷酸(dCTP)的内在水平。在本研究中,研究人员通过GLUT1/ALDOB/G6PD轴来重塑葡萄糖- pdac的葡萄糖代谢,从而揭示了其耐药机制。在葡萄糖- pdac中下调ALDOB可解除对G6PD和氧化性PPP的抑制,从而增加PPP通量以满足生物能量和生物合成需求。这一新的代谢重定向策略使葡萄糖- PDAC类器官能够扩大细胞内的嘧啶池,进而通过分子竞争使化疗无效。一致的是,靶向GLUT1/ALDOB/G6PD轴的疗法只有与作用于DNA合成的化疗药物联合使用时才有效。
癌细胞内的葡萄糖代谢重编程是满足合成代谢需求所必需的,为治疗提供了靶点。靶向抑制GLUT1/ALDOB/G6PD轴联合化疗可显著提高葡萄糖- PDAC的治疗应答。GLUT1对葡萄糖具有高亲和力,在许多癌症中过表达。本研究和既往研究表明,GLUT1的高表达与胰腺癌细胞的化疗耐药相关。一些抑制GLUT1的小分子已被证明在体外选择性地杀死癌细胞。本研究中,GLUT1的基因敲低或GLUT1活性的化学抑制在体外和体内都抑制了细胞活力和肿瘤进展。然而,GLUT1在不同类型的正常哺乳动物细胞中的广泛表达可能阻碍了这些抑制剂的临床应用。G6PD和PPP在多种肿瘤中的作用日益被认识,且G6PD表达上调与不良预后相关。G6PD抑制显著增加了葡萄糖-PDAC对化疗的治疗反应。因此,临床级G6PD抑制剂可能有改善PDAC治疗应答的潜力。
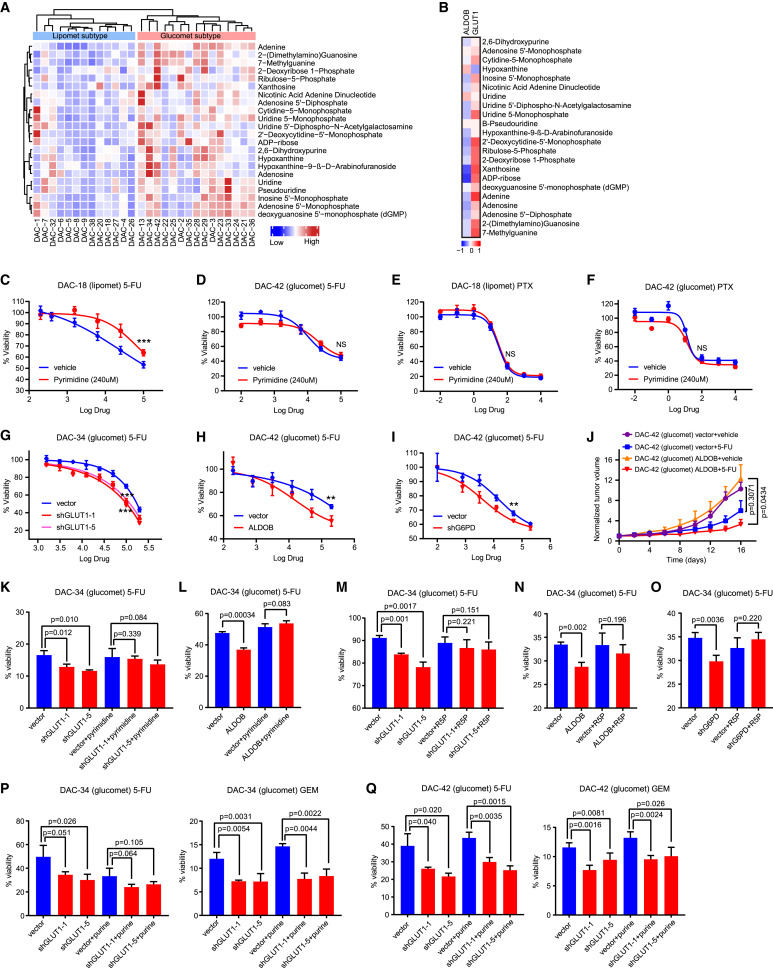
GLUT1/ALDOB/G6PD轴参与耐药
研究意义
03
总之,本研究提供了一种基于代谢特征的新的PDAC分类策略,并报告了GLUT1/ALDOB/G6PD轴通过重塑葡萄糖-PDAC的葡萄糖代谢诱导化疗耐药。这些结果为未来针对GLUT1/ALDOB/G6PD轴的药物开发和临床试验提供了强有力的理论基础,以克服代谢重编程驱动的化疗耐药。(转化医学网360zhyx.com)
参考资料:
https://doi.org/10.1016/j.xcrm.2023.101162
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发