双免疫+化疗方案“共战”肠癌!治疗RAS突变晚期结直肠癌有效率超60%!
| 导读 | 尽管微卫星不稳定转移性结直肠癌 (CRC) 患者受益于免疫检查点阻断,但靶向治疗化疗仍然是微卫星稳定 (MSS) 肿瘤的唯一治疗选择。 |
近日,法国研究者们在《Nature Medicine 》发表了一项临床I/II期研究成果“First-line durvalumab and tremelimumab with chemotherapy in RAS-mutated metastatic colorectal cancer: a phase 1b/2 trial”,首次揭示由PD-L1抑制剂(度伐利尤单抗)+CTLA-4抑制剂(tremelimumab)组成的双免疫方案+标准化疗,一线治疗携带RAS突变的MSS型晚期CRC客观缓解率(ORR)高达64.5%,患者中位无进展生存期(PFS)为8.2个月。

https://www.nature.com/articles/s41591-023-02497-z
研究背景
转移性结直肠癌(CRC)的治疗主要依赖于化疗,通常用于无法切除转移瘤时的姑息治疗。随着化疗和靶向治疗的改善,CRC 的中位总生存期(OS)一直在上升。结直肠癌是一种异质性疾病,按其遗传特征分类,指导预后和治疗CRC的一个特殊遗传亚群是具有微卫星不稳定性(MSI)的肿瘤,导致高肿瘤突变负荷(TMB)和大量免疫浸润。对于此类肿瘤,使用靶向PD-1/PD-L1的单克隆抗体进行免疫治疗已证明有效。对于其他CRC类型,称为微卫星稳定(MSS),免疫疗法作为单药治疗无效。
许多研究强调,免疫系统识别结直肠癌、高CD8 T细胞浸润与局部或转移性结直肠癌的预后更好有关。临床前数据表明,将PD-1/PD-L1抑制剂与免疫原性细胞死亡诱导剂(如奥沙利铂)联合使用可以提高免疫治疗效果。5-氟尿嘧啶(5-FU)可消除髓源性抑制细胞,限制肿瘤诱导的免疫抑制。因此,联合使用5-FU和奥沙利铂可以改善抗肿瘤免疫反应。在小鼠CRC模型中,观察到抗PD-L1 + FOLFOX组合的协同效应。基于这些数据,我们设计了1b/2期MEDITREME试验(NCT03202758)。在本文中,患者接受3个月的改良mFOLFOX6方案(6个周期)联合度伐利尤单抗和曲美木单抗作为诱导治疗,然后使用度伐利尤单抗进行维持治疗直至进展。目的是研究MSS转移性结直肠癌的可行性和有效性,并探索反应的基因组和免疫学特征。为了获得同质的反应率和无进展生存期(PFS),我们专注于RAS突变肿瘤患者。
研究结果
本次研究共纳入了57例不可手术切除的RAS突变型晚期CRC患者,其中51例接受了微卫星状态评估,48例为MSS型并组成后续疗效分析集。由于研究的联合治疗用药较多(双免疫+mFOLFOX方案),3-4级不良事件的发生率达67%,且有7例患者因不良事件停药,但绝大多数不良事件都被判定为化疗相关。
研究主要终点设定为疗效分析集患者3个月时的PFS率,双免疫+化疗方案交出的数字是90.7%,显著优于研究者预计的70%,患者12个月PFS率则为26.9%,同时64.5%的ORR也达到了次要疗效终点,中位缓解持续时间则是8.5个月。
在总生存期(OS)方面,中位随访时间达36个月时,全部患者的中位OS尚未达到,12和24个月OS率分别为81.1%和57.6%。而截至此次分析Cut-off时,仍有8例患者处于治疗后的完全缓解状态,生存时间有望再创新高。
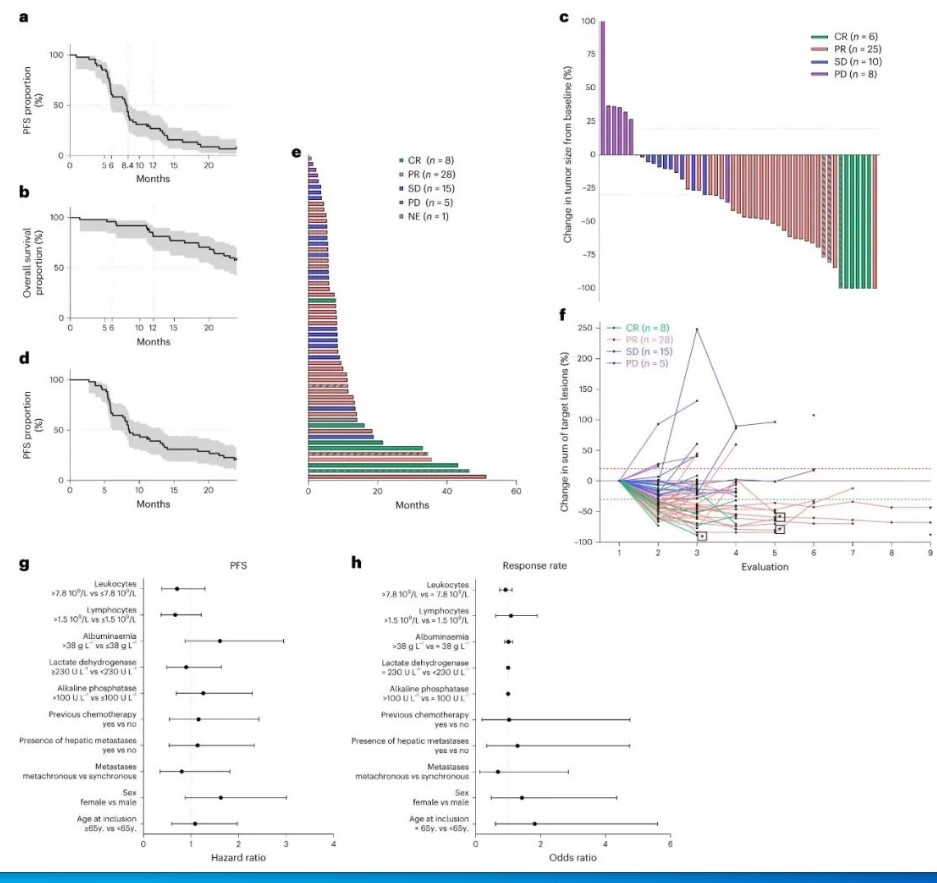
患者PFS、OS等疗效指标情况
研究意义
本研究表明,双免疫方案在ORR和PFS两项关键疗效指标上,都显著优于既往化疗或免疫单药治疗用于MSS型晚期CRC的表现,且研究者们还对患者转录组学情况、免疫微环境特征等展开了深入分析,相关信息有望在未来指导更精准的CRC免疫联合治疗。
综上所述,我们报道了一线化学免疫治疗不可切除的MSS转移性CRC的良好临床疗效,并进行了深入的分子和免疫分析,为更好地选择MSS转移性CRC患者进行化学免疫治疗提供了线索,具有潜在的广泛临床意义。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41591-023-02497-z
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发