重磅!麻省理工团队揭秘癌细胞死亡或进入衰老的关键因子
| 导读 | 哺乳动物细胞中的遗传毒性应激,包括由抗癌化疗引起的应激,可诱导暂时的细胞周期停滞、DNA损伤诱导的衰老(DDIS)或凋亡细胞死亡。尽管具有明显的临床重要性,但尚不清楚DNA损伤产生的信号如何与其他监测细胞环境和/或内部状态的细胞信号通路整合在一起,以控制不同的细胞命运。 |
近日,麻省理工研究团队的研究人员在《Cell Systems》上发表研究论文“Biphasic JNK-Erk signaling separates the induction and maintenance of cell senescence after DNA damage induced by topoisomerase II inhibition”,研究结果确定了超越经典DNA损伤反应(DDR)的信号通路在时间上的不同作用,这些信号通路控制细胞衰老决策并调节肿瘤微环境,并揭示了负责癌基因诱导衰老(OIS)的信号通路与拓扑异构酶II抑制引起的衰老之间的基本相似性。

https://doi.org/10.1016/j.cels.2023.06.005
研究背景
尽管免疫疗法或靶向疗法等新疗法激增,但放疗和化疗仍然是癌症患者的一线治疗方法。大约一半的患者仍在接受放疗,60%-80%的患者接受化疗。
放疗和化疗都利用癌细胞特有的脆弱性,通过破坏DNA起作用。健康细胞更有可能在放疗和化疗中存活下来,因为它们识别和修复DNA损伤的机制是完整的。在癌细胞中,这些修复机制受到突变的影响。当癌细胞不能充分响应放疗和化疗引起的DNA损伤时,理想情况下,它们会发生细胞凋亡或通过其他方式死亡。
然而,DNA损伤后的细胞还有另一种命运:衰老——细胞存活但停止分裂的状态。衰老细胞的DNA尚未受损到足以诱导细胞凋亡的程度,但受损程度太高,无法支持细胞分裂。虽然衰老的癌细胞本身无法增殖和扩散,但它们是对抗癌症的坏演员,因为它们似乎使其他癌细胞能够更积极地发展。
虽然癌细胞的命运直到治疗后几天才显现出来,但存活、死亡或进入衰老的决定要早得多。确切地说,癌细胞何时以及如何做出这一决定尚未得到很好的理解。
研究进展
为了系统地研究DNA损伤后的细胞命运决定,我们在暴露于不同水平的阿霉素诱导的DNA损伤的U2OS骨肉瘤细胞系中进行了一项定量的时间分辨细胞信号传导和表型反应研究,目的是使用数据驱动的模型来表明信号传导活性与细胞结果之间的新关系。我们对识别表示衰老和细胞凋亡路径上不同时间阶段的信号事件特别感兴趣。衰老细胞主动重新连接其分子信号网络以永久阻止其细胞周期,对血清刺激不敏感,改变其形态并产生相关的分泌表型。我们试图确定控制从增殖癌细胞到衰老细胞过渡的信号通路及其活动动力学。
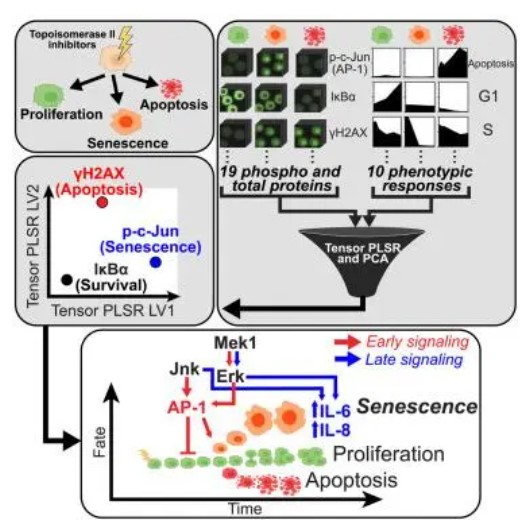
概述图
研究过程中,我们报道了转录因子AP-1及其上游激活剂、应激和丝裂原激活蛋白激酶JNK和Erk,在细胞命运决策中起重要作用,在早期以停滞诱导(但非致命)剂量的DNA损伤衰老,并在后期促进DNA损伤诱导的SASP。我们的研究结果来自在多次用不同剂量的阿霉素处理的U2OS细胞中收集的信号传导和DNA损伤诱导反应的结构化多维数据集(张量)。数据通过张量和矩阵分解方法建模,以产生对关键时间相关信号的预测,并通过独立的实验测试进行验证。
综上所述,该系统分析指出了SAPK / MAPK信令在可分离的不同时间尺度上调节DDIS和SASP中的基本作用,并揭示了负责OIS和DDIS的信令事件之间的相似性。
在未来的工作中,该团队将继续进行研究,以了解单个细胞如何以及为什么选择增殖而不是进入衰老。此外,该团队正在采用下一代测序来了解c-Jun正在调节哪些基因,以推动细胞衰老。(转化医学网360zhyx.com)
参考资料:
https://medicalxpress.com/news/2023-07-dosage-dna-damaging-drugs-key-cancer.html
https://doi.org/10.1016/j.cels.2023.06.005
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录







还没有人评论,赶快抢个沙发