首次!中南大学湘雅医院团队最新研究发布
| 导读 | 线粒体细胞凋亡由BCL-2家族蛋白通过微妙的蛋白质相互作用网络严格控制。肿瘤抑制蛋白p53通过与BCL-2家族蛋白的直接相互作用触发转录非依赖性细胞凋亡,但其分子机制尚不清楚。 |
近日,中南大学湘雅医院国家卫健委肿瘤蛋白质组学重点实验室/抗癌药物国家地方联合工程实验室陈永恒教授团队在《Nature Communications》上发表题为“Structures of p53/BCL-2 complex suggest a mechanism for p53 to antagonize BCL-2 activity”的原创性研究论文。该研究不仅首次阐明了p53结合抗凋亡蛋白BCL-2的结构基础,还首次揭示了p53通过竞争性抑制BCL-2与其家族促凋亡蛋白相互作用,以转录非依赖性方式促进细胞凋亡的新机制。
https://www.nature.com/articles/s41467-023-40087-2
研究背景
细胞凋亡失调在肿瘤发生和耐药性中已被广泛描述,激活癌细胞凋亡是临床肿瘤学的主要目标。BCL-2家族蛋白和肿瘤抑制蛋白p53是细胞凋亡信号通路中的中枢调节因子。p53通过转录依赖性途径调节BCL-2家族的活性。作为一种核转录因子,p53转录激活促凋亡基因的表达,如NOXA、Bax和Puma7。在细胞质和线粒体膜中,p53还通过与抗凋亡蛋白BCL-2和BCL-xL8形成抑制复合物或通过激活促凋亡效应蛋白Bak和Bax来触发细胞凋亡。
促凋亡和抗凋亡BCL-2家族蛋白通过蛋白相互作用网络严格控制线粒体凋亡途径(也称为内在细胞凋亡途径)。Bak和Bax直接控制线粒体外膜(OMM)的完整性和细胞凋亡的启动。响应凋亡刺激,Bak和Bax直接或间接地被促凋亡的BH3激活剂或敏化剂激活,并在OMM上形成孔,这导致细胞色素C释放到细胞质中并激活半胱天冬酶级联反应。然而,抗凋亡BCL-2蛋白通过大的疏水口袋(称为BH3结合口袋)规范结合并隔离促凋亡蛋白的BH3结构域,从而拮抗促凋亡蛋白的活性。这种规范的相互作用机制促进了BH3模拟药物的开发,BH3模拟药物通过竞争性占据BH3结合口袋选择性地抑制抗凋亡BCL-2成员。
p53在预防癌症发展方面起着至关重要的作用。在大约 50% 的人类癌症中,p53 功能被基因突变消除。p53与抗凋亡蛋白BCL-2和BCL-xL的直接相互作用在p53介导的线粒体凋亡途径中具有重要作用。p53的活性取决于其DNA结合结构域(p53-DBD)。p53-DBD在与BH3结合口袋不同的表面上结合BCL-xL,如NMR和晶体结构研究所证明的那样。我们先前的p53-DBD/BCL-xL配合物晶体结构表明,p53-DBD形成同源二聚体,并在由α1和α5的C端残基、α5-α6环和α3-α4环组成的表面上与BCL-xL结合21。BCL-2和BCL-xL具有45%的序列同一性,而它们对与促凋亡蛋白的相互作用具有不同的敏感性。
研究进展
人 p53 是一种多结构域蛋白,由 N 端反式活化结构域(NTD,残基 1-92)、与四聚化结构域(TET,残基 96-292)相连的核心 DNA 结合结构域(DBD,残基 324-356)和 C 末端结构域(CTD,残基 364-393)组成。 DBD 是负责绑定 BCL-2 的主域。人类BCL-2包含四个BCL-2同源结构域(BH1-4)和一个C端跨膜结构域。
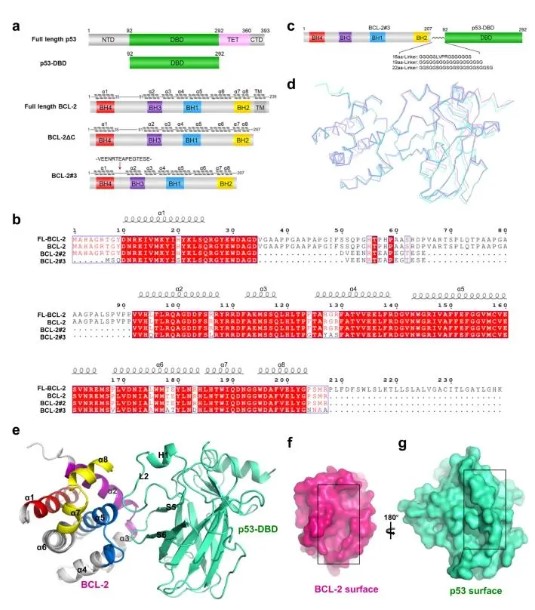
p53-DBD/BCL-2配合物的晶体结构
为了研究p53和BCL-2之间的相互作用,我们进行了晶体学结构分析。通过将p53-DBD与BCL-2蛋白混合来结晶p53-DBD / BCL-2复合物的初步试验失败了。为了稳定p53-DBD/BCL-2复合物,我们使用了融合策略。
首先,BCL-2通过富含甘氨酸的接头与p53-DBD连接,该接头以前用于p53-DBD / BCL-xL复合物以增加两种蛋白质之间的接近度。然而,我们注意到BCL-2构建体(BCL-2#3)具有缩短的α1-α2环和某些表面残基被BCL-xL序列取代,可以高产率表达,适合结晶。据报道,BCL-2#3对仅BH3肽的选择性特征与野生型BCL-2相似,并且与BCL-xL特异性肽Hrk的相互作用较弱。截断策略已用于BCL-2家族的许多生化和结构研究,例如BCL-2#2用于BCL-2溶液NMR,BCL-2 / Bax-BH3和BCL-2 / venetoclax的晶体结构, BCL-2#3用于BCL-2/美洲狮-BH3等晶体结构。为了提高结晶的成功率并确保接头不会影响蛋白质相互作用,我们通过三种不同的富含甘氨酸的接头将该BCL-2#3构建体连接到p53-DBD。凝胶过滤色谱分析表明融合蛋白高度均一。此外,微量热泳(MST)测定表明,p53-DBD对BCL-2(3.5μM)和BCL-2#3(3.9μM)具有相似的KD值,表明BCL-2的修饰不影响其与p53-DBD的结合亲和力。
在这些结晶尝试中,BCL-2融合蛋白可以获得小的针状晶体,但很难针对X射线衍射优化它们。特别是,三种BCL-2#3-接头-p53-DBD融合蛋白的晶体成功地针对X射线衍射进行了优化,并在P 21 21 21空间组中以2.3-2.7 Å的分辨率测定。这三种结构叠加的RMSD为0.2–0.5 Å。p53-DBD和BCL-2#3在3种结构中具有相似的相互作用模式,表明接头不影响复杂结构。此后,我们使用22个残基连接的复合结构作为详细分析的代表结构。在p53-DBD/BCL-2#3复合物结构中,p53-DBD分子与p53-DBD(PDB:2OCJ)30的apo结构具有相似的整体结构,RMSD为0.4Å。p53的两个环,连接链S5和S6的环(S5-S6环)和大环L2,插入由BH1-3结构域组成的BCL-2#3的BH3结合口袋中。BCL-2#3的整体结构与BCL-2的apo溶液结构非常相似(PDB:1GJH)26,α3和α4区域以及α2和α5的C末端有小的构象变化。值得注意的是,BCL-2的柔性环和改性残基不位于与p53-DBD的接触表面上。这表明BCL-2的修饰对复杂结构的影响最小。
研究意义
总之,我们的研究阐明了p53/BCL-2相互作用的结构基础,并揭示了p53通过直接占据BH2结合口袋并释放螯合在口袋中的促凋亡BCL-3家族蛋白来拮抗BCL-2活性的分子机制。这些结构和功能数据为p53介导的线粒体细胞凋亡的复杂调控机制提供了见解。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41467-023-40087-2
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录







还没有人评论,赶快抢个沙发