【Cell Death Dis】显著抑制肿瘤生长/转移!诱导铁死亡的新机制
| 导读 | 铁死亡的的本质是谷胱甘肽的耗竭,谷胱甘肽过氧化物酶(GPX4)活性下降,脂质氧化物不能通过GPX4催化的谷胱甘肽还原酶反应代谢,之后二价的铁离子氧化脂质产生活性氧,从而促使铁死亡的发生。 |
铁死亡是一种程序性细胞死亡,已被确定并与癌症和各种其他疾病有关。铁死亡是一种与铁积累和脂质过氧化有关的活性氧(reactive oxygen species, ROS)依赖性细胞死亡,不同于凋亡、坏死、自噬等其他形式的细胞死亡。
然而,越来越多的证据揭示了自噬与铁死亡在分子水平上的联系,并表明自噬参与调节铁死亡过程中铁依赖性脂质过氧化和ROS的积累。了解铁中毒过程中自噬的作用和病理生理过程可以为铁中毒相关疾病的治疗提供有效的策略。在这篇综述中,我们总结了目前关于铁死亡的调节机制,包括铁和脂质代谢,以及它与自噬途径的关系。此外,我们讨论了自噬对铁死亡的贡献,并阐明了自噬在ROS依赖性铁死亡过程中作为铁死亡增强剂的作用。

https://www.nature.com/articles/s41419-023-05978-8
研究背景
01
细胞死亡在多种人类疾病的发展中至关重要,并与生物生长密切相关。铁死亡是近十年来发现的一种新的细胞死亡类型。最初,铁死亡已被发现作为一种新的铁依赖形式的非凋亡调节细胞死亡。铁死亡与铁、ROS、脂质过氧化和消除脂质过氧化的能力不足有关。此外,铁死亡与肿瘤、退行性疾病、缺血再灌注损伤、肾损伤、血液病等多种疾病的病理生理密切相关,并具有抑瘤功能,可用于抗癌。特别是,研究表明,针对铁死亡可能是一种针对不同癌细胞类型的潜在策略。一项研究表明,IDH1或IDH2基因突变的AML细胞对诱导铁中毒的药物特别敏感,这种敏感性是由肿瘤代谢物2-羟戊二酸(2-HG)的积累介导的。此外,抑制肝癌细胞铁死亡可促进肿瘤生长和转移,而诱导铁死亡可抑制肿瘤生长和减少转移。另一项研究报道,铁死亡参与黑色素瘤(一种皮肤癌)的肿瘤免疫反应调节。
铁死亡的药物调控已成为相关疾病治疗和预后的研究热点。虽然铁死亡在某些情况下被证明具有抗肿瘤作用,但它也可以在其他情况下促进肿瘤生长和生存。作为一种抗肿瘤作用,经典的铁死亡诱导剂与System Xc-/谷胱甘肽(GSH)/谷胱甘肽过氧化物酶4 (GPX4)轴相关,该轴在调节抗氧化系统和脂质过氧化中起核心作用。除致癌的RAS (Rat sarcoma virus oncogene)-选择性致死小分子外,erastin、RAS-选择性致死化合物3 (RAS-selective-lethal compound 3, RSL3)以及柳氮磺胺吡啶、索拉非尼、青蒿素和1,2 -二氧戊烷(1,2 -dioxolane, FINO2)等其他化合物已被证实可诱导铁死亡。例如,在某些癌症亚型(如胶质母细胞瘤和急性髓系白血病[AML])中,诱导铁死亡已被证明具有抗肿瘤作用。
研究过程
02
铁死亡过程中铁蓄积的机制
铁是生物系统的重要组成部分,以两种生物学相关的氧化态存在,三价铁(Fe3+)和二价铁(Fe2+),并作为多种蛋白质和酶的辅因子,易于进行氧化还原循环。具体而言,过量的铁会启动几种破坏氧化还原稳态并导致细胞死亡的细胞毒性机制,包括铁死亡。
由于铁在脂质过氧化过程中调节ROS生成和酶活性,因此通过铁代谢(包括铁的摄取、储存、利用和输出)维持铁稳态为确定铁死亡敏感性提供了统一网络。大多数生物铁来自营养来源和血红蛋白(一种红细胞成分),通过肠黏膜细胞直接吸收到血流中,并部分储存在铁蛋白中。转铁蛋白(TF)是一种糖蛋白,与Fe3+结合并将其通过血液运输到各种组织,如肝、脾和骨髓。来自血清的TF结合的铁被转铁蛋白受体(TFRC/TfR1)识别,然后通过受体介导的内吞作用将TF-TFRC复合体内化。TFRC过表达导致的铁摄取增加增强了对铁死亡的敏感性,而TFRC敲低可改善erastin诱导的铁死亡。因此,TFRC可以作为铁死亡敏感性的生物标志物.
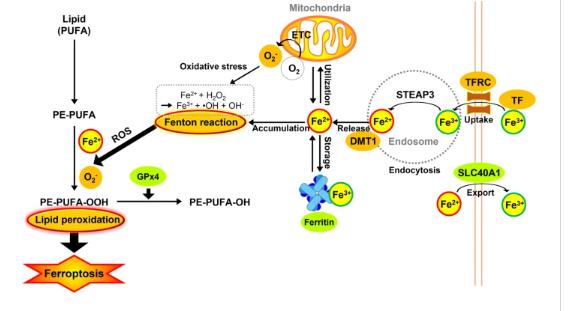
铁死亡中的铁分子代谢
研究成果
03
铁死亡是一种由铁依赖性脂质过氧化作用驱动的细胞死亡过程。近年来,随着对铁死亡分子机制的深入研究,揭示了一个复杂的调控机制。铁死亡已被证明在多种疾病的发生和发展中发挥着重要的调控作用。通过调节脂质过氧化直接控制铁死亡可影响疾病治疗,然而,诱导铁死亡的来源多种多样,而且铁死亡也与疾病发展有关。高度转移和耐药的癌症非常容易受到铁死亡诱导的治疗;然而,神经变性、卒中和神经创伤等神经系统疾病的病理生理学与铁死亡相关。因此,阐明铁死亡的机制可以提高我们对人类疾病的理解,并为各种疾病提供潜在的预防和治疗干预措施。
在这篇综述中,我们讨论了自噬通过ROS扩增环作为铁死亡增强剂的作用。我们总结了在ROS依赖性铁死亡中,自噬由ROS触发,包括铁蓄积介导的ROS和基于脂质的ROS,然后放大铁蓄积和脂质过氧化,进而在特定条件下诱导自噬性细胞死亡。因此,针对铁死亡中自噬、铁和ROS之间的相互作用的治疗策略可以为疾病的治疗提供新的有前景的方向,并改善治疗方案。此外,各种类型的自噬如铁自噬、线粒体自噬、脂自噬、钟自噬等均可促进铁死亡。然而,促进铁死亡的自噬类型尚不清楚,需要进一步研究来确定调节自噬依赖性铁死亡的新靶点分子。因此,进一步研究自噬与铁死亡病理通路之间的关系,可以为疾病的发展提供新的思路。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41419-023-05978-8
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录








还没有人评论,赶快抢个沙发