最新!中山大学发现乳腺癌曲妥珠单抗耐药性的调控新机制 揭示治疗新靶点
| 导读 | 导读:人表皮生长因子受体2靶向(HER2靶向)治疗是HER2阳性乳腺癌的主要治疗方法。然而,HER2的蛋白水解裂解或HER2脱落会诱导外结构域(ECD)目标表位的释放和组成性活性细胞内片段(p95HER2)的产生,从而阻碍抗HER2治疗的有效性。 |
近日,中山大学研究人员在知名期刊《Journal of Clinical Investigation》上发表了题为“Inhibition of DPAGT1 suppresses HER2 shedding and trastuzumab resistance in human breast cancer”的研究论文,该研究发现抑制DPAGT1可抑制人乳腺癌中HER2的脱落和曲妥珠单抗耐药性。在曲妥珠单抗治疗后,膜结合的DPAGT1蛋白通过小泡途径内吞并逆行转运到内质网,DPAGT1诱导脱落酶- ADAM金属肽酶结构域10 (ADAM10)的N-糖基化,以确保其表达、成熟和激活。

https://www.jci.org/articles/view/164428
研究背景
01
人表皮生长因子受体2阳性(HER2+)乳腺癌是指HER2(也称为ERBB2)过表达和/或扩增的乳腺癌肿瘤,占所有乳腺癌病例的20%-30%。值得注意的是,HER2+乳腺癌的特点是HER2信号的持续激活,这已经成功地利用单克隆抗体(如曲妥珠单抗)进行选择性靶向治疗。临床上,曲妥珠单抗治疗在HER2+乳腺癌患者中获得显著的生存益处。然而,大约15%的早期HER2+乳腺癌患者在辅助曲妥珠单抗治疗后复发,晚期HER2+乳腺癌患者接受基于曲妥珠单抗的姑息治疗将不可避免地在大约12个月内出现疾病进展。此外,单药曲妥珠单抗的客观缓解率仅为12%-34%。
胞外结构域(ECD)脱落诱导蛋白胞外结构域的蛋白水解裂解,在调节多种细胞表面受体的活性中起重要作用,包括细胞因子受体-肿瘤坏死因子受体1 (TNFR1)和白细胞介素6受体(IL6R) -缺口受体、转化生长因子β (TGFβ)受体和受体酪氨酸激酶(RTK) -HER2, HER4,血管内皮生长因子受体2 (VEGFR2)和MET原癌基因,受体酪氨酸激酶(c-MET)。最近,跨膜受体ECD脱落的失调被报道有助于肿瘤进展和耐药。特别是,HER2受体的脱落导致可溶性HER2- ecd的释放,其中包含曲妥珠单抗识别表位,但保留膜相关的致癌p95HER2片段。重要的是,肿瘤细胞中的p95HER2片段发挥更高的酪氨酸激酶活性,促进癌细胞生长和存活,这在很大程度上有助于曲妥珠单抗耐药。在几种HER2过表达的癌症中发现了HER2的脱落,包括乳腺癌、胃癌和子宫浆液性癌。高达30%的HER2+乳腺癌患者肿瘤p95HER2或血清HER2- ecd升高,这与曲妥珠单抗反应减弱和预后不良有关。然而,HER2脱落的机制在很大程度上仍然是个谜。因此,确定参与HER2脱落的关键调节因子可能为预防或克服曲妥珠单抗耐药开辟新的途径。
研究过程
02
在本研究中,研究人员发现DPAGT1上调与HER2+乳腺癌患者曲妥珠单抗治疗反应差和预后差相关。研究人员进一步证明了DPAGT1在调节HER2脱落和HER2信号持续激活中的关键作用,从而导致曲妥珠单抗耐药。重要的是,使用SHRNA介导的下调或抑制剂介导的失活靶向DPAGT1可显著逆转HER2+乳腺癌肿瘤中的曲妥珠单抗耐药。因此,这些结果表明DPAGT1可能是抗曲妥珠单抗耐药的潜在治疗靶点。
在本研究中,数据表明,上调糖基转移酶DPAGT1,诱导ER中ADAM10的n -糖基化,以酶依赖性方式促进HER2脱落和曲妥珠单抗耐药。重要的是,dpagt1介导的n -糖基化促进了ADAM10脱落酶的稳定和成熟,从而维持了高水平的HER2脱落。因此,这些发现为n -糖基化在HER2脱落和曲妥珠单抗耐药中发挥关键作用提供了重要证据。
在本研究中,筛选了来自血清HER2- ecd水平高且对曲妥珠单抗反应差的患者的活检,以确定HER2脱落和曲妥珠单抗耐药的内在启动子。正如预期的那样,HER2+乳腺癌细胞和DPAGT1过表达的肿瘤显示出更高水平的HER2脱落,并且对曲妥珠单抗具有难治性。DPAGT1在原发性HER2+乳腺肿瘤中的高表达与患者预后不良相关,表明DPAGT1本质上促进了曲妥珠单抗耐药。值得注意的是,曲妥珠单抗可以抑制HER2的脱落,这表明可能需要一种适应性机制来维持高水平的HER2脱落以产生耐药性。
在本研究中,TM作为一种有效的糖基化抑制剂,被用于抑制DPAGT1活性。虽然几十年前就报道了TM在多种癌症中的抗癌作用,但TM治疗对几种正常细胞(如神经元和造血细胞)也显示出严重的毒性,这阻碍了其临床应用。值得注意的是,多个实验室正在努力开发具有低毒性和强肿瘤杀伤活性的TM类似物。重要的是,低浓度的APPB已经在多种实体肿瘤中表现出选择性抑制作用,对正常细胞的毒性有限,并且CPPB单独治疗可以抑制癌细胞的迁移,并在胰腺癌中显示出与化疗的协同作用。值得注意的是,APPB和CPPB在体内均表现出可耐受的溶血活性。因此,进一步探索APPB、CPPB或其他TM衍生类似物在曲妥珠单抗耐药HER2+乳腺癌中的抗癌作用是有必要的。
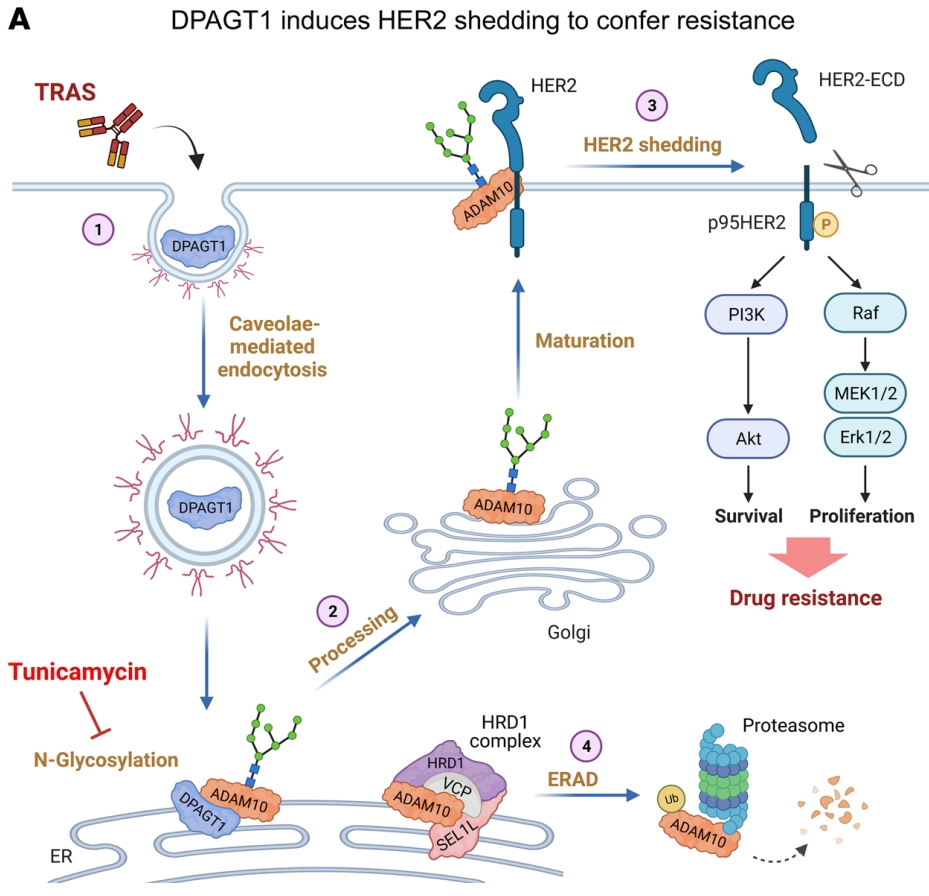
DPAGT1在HER2+乳腺癌中诱导HER2脱落和曲妥珠单抗耐药的机制
研究意义
03
TCGA数据分析显示,DPAGT1在多种HER2过表达的人类癌症中表达增加。进一步研究靶向DPAGT1对HER2+癌症类型HER2脱落和曲妥珠单抗耐药的影响具有重要意义,这可能是治疗曲妥珠单抗耐药HER2+癌症的一种有希望的策略。(转化医学网360zhyx.com)
参考资料:
https://www.jci.org/articles/view/164428
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发