重磅!中南湘雅医院发现肝癌治疗新靶点
| 导读 | 导读:表观遗传调控因子和蛋白质翻译后修饰在多种癌症细胞死亡中发挥重要作用,包括铁死亡(一种非凋亡形式的细胞死亡)。然而,染色质修饰因子和去泛素化酶(DUB)在铁死亡中的相互作用尚不清楚。 |
近日,中南湘雅医院研究人员在期刊《MedComm》上发表了题为“The ubiquitin-specific protease 5 mediated deubiquitination of LSH links metabolic regulation of ferroptosis to hepatocellular carcinoma progression”的研究论文,该研究发现泛素特异性蛋白酶5 (USP5)在肝细胞癌(HCC)中被认为是淋巴特异性解螺旋酶(LSH)的一个真正的DUB, LSH是一个DNA甲基化抑制因子。功能研究揭示USP5与LSH相互作用并通过去泛素化活性依赖性过程稳定LSH。USP5介导的LSH去泛素化通过上调溶质载体家族7成员11 (SLC7A11)抑制肝癌细胞铁死亡,促进HCC的发生。另外,USP5抑制剂可抑制USP5对LSH的DUB活性,从而抑制HCC的进展。而且,在HCC患者中,USP5与LSH呈正相关,两者均过表达并与预后不良有关。

https://onlinelibrary.wiley.com/doi/10.1002/mco2.337#pane-pcw-figures
研究背景
01
肝细胞癌(HCC)是最常见的恶性肿瘤之一,在世界范围内发病率和死亡率分别位列第六和第三。由于HCC转移和复发的发生率高,放疗和化疗对大多数HCC患者的疗效有限,手术治疗仅限于肿瘤早期,因此迫切需要明确HCC的潜在机制,以有效治疗HCC。
铁死亡是一种主要由细胞内铁催化活性和脂质过氧化引起的与代谢相关的、受调节的细胞死亡,定义为细胞内脂质过氧化物蓄积和氧化还原失衡。铁死亡作为一种应激反应参与了一些退行性疾病、各种肾脏疾病、肝脏疾病、脑损伤和卒中等。同时,大量研究表明,肿瘤细胞对铁死亡的高度易感性为多种肿瘤,尤其是肝癌的治疗提供了难得的机会。铁死亡是索拉非尼通过胱氨酸/谷氨酸反向转运体SLC7A11治疗肝癌的潜在机制之一。包括中草药在内的天然产物的提取物和单体为诱导铁死亡抑制肝癌提供了新的策略。
表观遗传学主要包括DNA甲基化、组蛋白修饰、非编码RNA和染色质重塑,表观遗传学决定基因转录,对细胞命运和发育过程有重要影响。癌细胞经常破坏预先存在的表观遗传系统,以一种促进癌症生长的方式重新编程基因表达。近年来,许多研究表明,包括lncRNA、去泛素酶(deubiquitinase, DUB)和硒在内的多种表观遗传调节因子通过调节代谢基因和中间体,导致脂质过氧化水平的改变,在铁死亡中起着至关重要的作用。
研究过程
02
在各种癌症中,染色质重塑酶LSH水平升高并与不良临床结果相关,大量证据表明LSH促进肿瘤细胞的恶性进展。深入了解LSH的上游调控机制,对于发现治疗癌症的新靶点具有重要意义。在这里,研究人员确定了USP5是LSH的真正调节器。首先,USP5直接与LSH相互作用。其次,USP5通过去泛素化增强LSH蛋白的稳定性,而这种能力可以被USP5抑制剂抑制。最后,USP5可通过DUB LSH抑制铁死亡,促进肿瘤进展。
USP5作为dub家族中唯一能够特异性识别非锚定泛素的成员,参与了DNA修复、发育和应激反应等多种生物学过程。USP5可以调控许多肿瘤发生相关蛋白的稳定性,从而促进肿瘤进展。然而,USP5在铁死亡中的作用尚不清楚。在本研究中,研究人员发现USP5可以通过稳定LSH来抑制铁死亡。Degrasyn 抑制剂可以剂量依赖性地降低USP5蛋白的表达。同时,Degrasyn可以靶向USP5增加LSH上的泛素化,从而促进铁死亡,抑制HCC进展。此外,研究人员发现只有USP5-WT,而不是USP5-C335A,可以通过去泛素化LSH来抑制铁死亡。
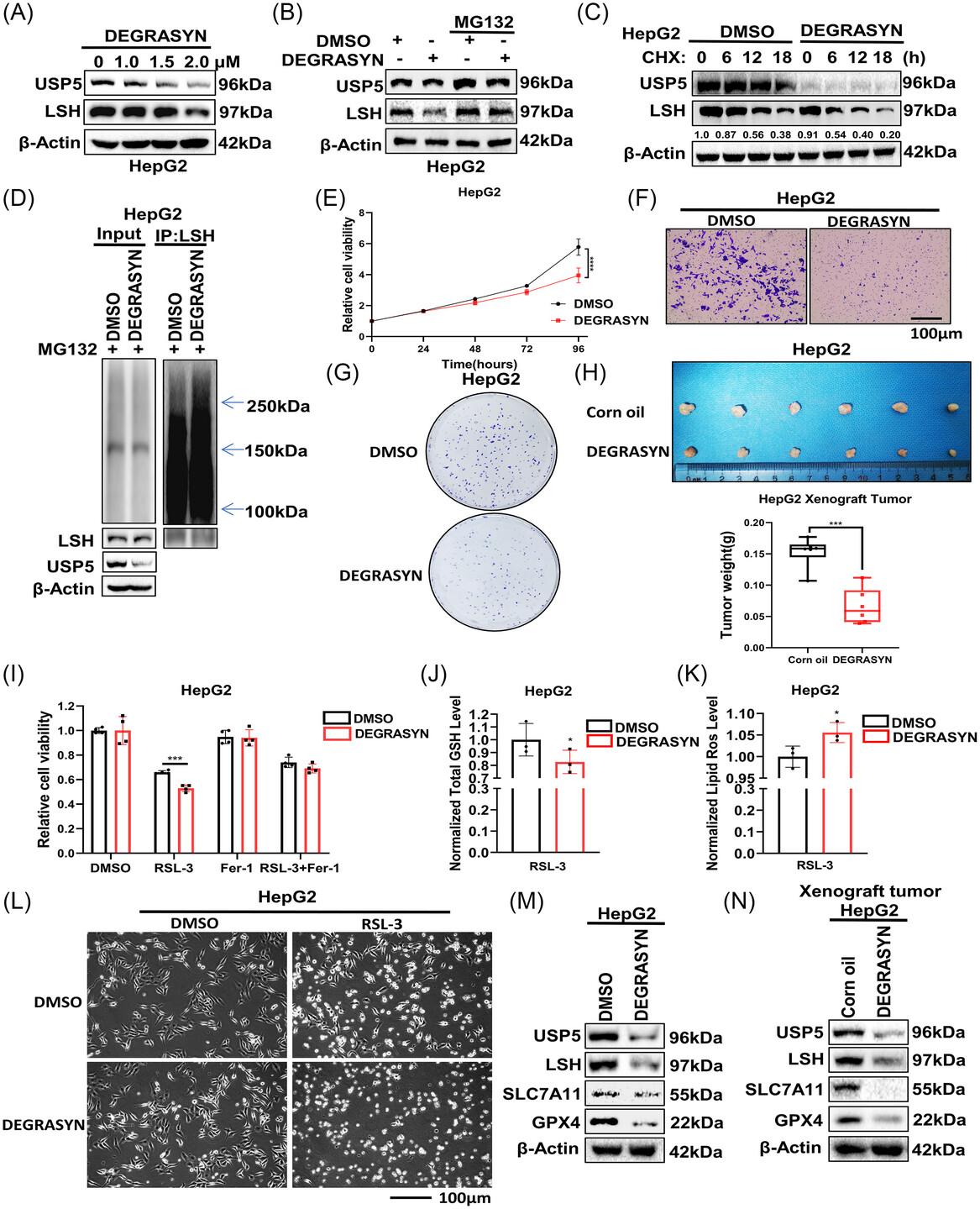
Degrasyn抑制剂通过靶向USP5促进铁死亡抑制肿瘤进展
研究意义
03
综上,研究人员确定USP5是LSH的DUB,通过稳定LSH蛋白来抑制肝癌细胞的铁死亡,从而促进细胞增殖和肿瘤生长。本研究揭示了LSH的一种新的调控机制以及Degrasyn抑制剂对HCC进展的有效抑制作用,表明USP5可能进一步发展为HCC的潜在治疗靶点。(转化医学网360zhyx.com)
参考资料:
https://onlinelibrary.wiley.com/doi/10.1002/mco2.337#pane-pcw-figures
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发