重磅!深圳大学发现乳腺肿瘤发生转移新机制 揭示乳腺癌治疗新靶点
| 导读 | 导读:基底细胞样乳腺癌是最具侵略性的癌症之一,部分原因是它们丰富了癌干细胞(CSCS)。乳腺癌细胞可通过上皮-间充质转变(EMT)生成乳腺CSCS。GATA3维持腔内细胞的命运,其表达在BBC中消失或减少。然而,在小鼠或细胞中删除GTA3会导致早期致死或增殖缺陷。目前还不清楚GTA3功能丧失如何调节乳腺癌的EMT和CSCS。 |
近日,深圳大学研究人员在期刊《Cell Death&Disease》上发表了题为“Loss of function of GATA3 regulates FRA1 and c-FOS to activate EMT and promote mammary tumorigenesis and metastasis”的研究论文,该研究报告在缺乏p18ink4c(一种细胞周期抑制剂)的小鼠中,单倍体的GATA3的丢失,使FER1(一种促进间质性状的AP-1家族蛋白)上升调节,并向下调节c-fos(另一种维持上皮命运的AP-1家族蛋白),导致EMT的激活和乳腺肿瘤的开始和转移。在EMT的激活过程中,管腔肿瘤细胞中GATA3的消耗同样地调节了FR1和c-FOS。GATA3与FOS1(编码FR1)和FOS(编码C-FS)本地结合,抑制FOS1并激活FOS转录。缺失的肿瘤细胞可抑制EMT,阻止肿瘤发生和(或)转移。

https://www.nature.com/articles/s41419-023-05888-9#Sec11
研究背景
01
越来越多的证据表明,癌症干细胞(CSCs)引发了肿瘤,并且特别具有放化疗耐药性,驱动了转移和不良预后。肿瘤干细胞是一种具有与干细胞相同的自我更新和多能性的肿瘤细胞亚群。肿瘤中的肿瘤干细胞可由非干细胞通过上皮-间充质转化(EMT)产生。EMT是指上皮细胞失去许多上皮特性而获得间充质特性的过程。乳腺癌主要分为雌激素受体(ER)阳性的管腔型和阴性的基底样型肿瘤。基底细胞样乳腺癌(BLBCs)是一种低分化和最致命的乳腺癌,部分原因是它们富集了CSC。我们和其他人已经证明,至少有一些BLBC起源于管腔上皮细胞或管腔肿瘤细胞。乳腺癌中控制EMT和CSC的分子机制仍有待阐明。
转录因子GATA3在维持乳腺管腔细胞命运和促进管腔细胞分化中起重要作用。高GATA3表达是光型乳腺癌的特征,预示着更好的生存率。GATA3常因DNA甲基化而沉默,其表达在BLBC和转移性乳腺癌中缺失或显著降低。然而,很难确定Gata3功能丧失在乳腺肿瘤发生和发展中激活EMT的机制。GATA3的功能缺失如何调节EMT和乳腺CSCs在肿瘤发生和发展中的作用仍然是未知的。
激活蛋白1 (Activator protein-1, AP-1)是一种异二聚体转录因子,由FOS和JUN家族的蛋白组成。AP-1复合物在激活EMT和驱动乳腺CSC功能中起关键作用。c-FOS(由FOS编码)主要表达于乳腺上皮细胞,激活E-cad转录,在维持上皮细胞状态中起关键作用。研究人员之前证明了在Gata3缺乏的乳腺癌中,FRA1的表达升高,EMT被激活。GATA3如何调控AP-1复合体在乳腺肿瘤发生和转移中的作用尚不清楚。
研究过程
02
研究结果表明,在乳腺肿瘤细胞中,GATA3直接激活FOS的转录以维持其管腔和上皮特征,同时抑制FOSL1的转录以抑制异常的间充质分化,即抑制EMT。研究人员还证明了在GATA3缺陷的肿瘤起始和转移过程中,FRA1是EMT激活所必需的。
c-FOS优先表达于乳腺上皮细胞系和非肿瘤干细胞,而FRA1则特异性地表达于肿瘤干细胞和发生EMT的乳腺上皮细胞。c-FOS结合并激活两种关键上皮蛋白E-cadherin和Crumb3的编码基因,以维持非肿瘤干细胞的上皮特征。研究证明了Gata3的缺失激活了Fosl1转录,同时抑制了EMT激活中的Fos转录,从而驱动肿瘤的起始和转移。研究数据提供了遗传学和生化证据,表明在乳腺肿瘤细胞中Gata3功能的丧失激活了Fosl1以促进间质特性和CSC功能,同时抑制Fos以失去上皮特征。此外,研究结果表明,在肿瘤发生过程中,在GATA3缺陷诱导的EMT中,Fosl1的激活高于Fos的抑制。
FOSL1在转录和转录后水平均受调控。磷酸化的FRA1与JUN转录因子家族成员结合形成异源二聚体AP-1复合物,通过转录调节靶基因的表达。EMT的激活和非干细胞CSCs的形成涉及从EGFR到PDGFR信号的转变,导致FRA1的pkc α依赖性激活。RCA1和GATA3在转录后水平上抑制PDGFRβ-PKCα信号通路,阻断FRA1的磷酸化,使其与JUN家族转录因子的关联消失,从而阻止靶基因表达的反激活。因此,研究人员提出PDGFRβ-PKCα-FRA1通路是gata3缺陷BLBC的潜在治疗靶点。
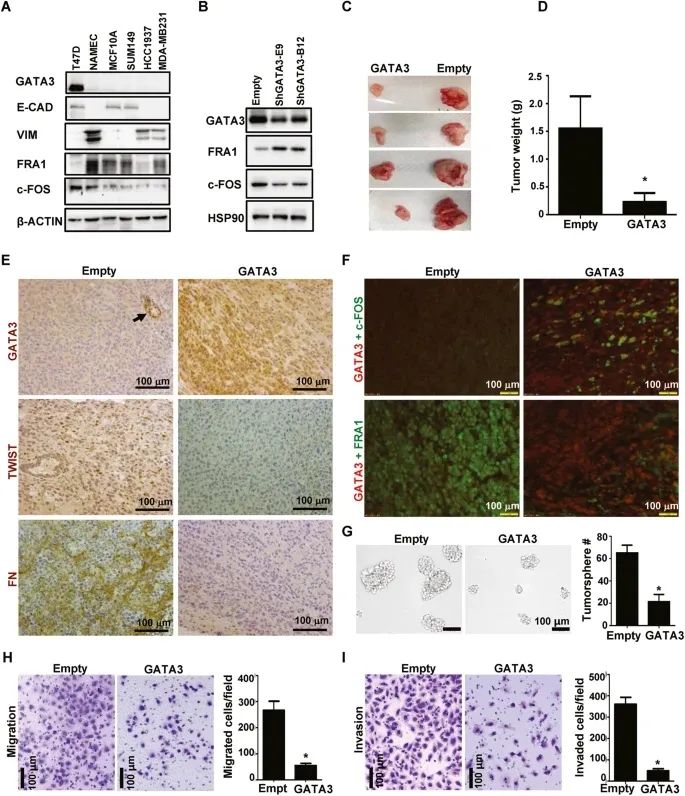
在抑制人类乳腺癌细胞的肿瘤发生和形成肿瘤的潜能方面,GATA3正调控c-fos,并负调控FER1
研究意义
03
综上,在缺乏p18ink4c(一种细胞周期抑制剂)的小鼠中,单倍体的GATA3的丢失,使FER1(一种促进间质性状的AP-1家族蛋白)上升调节,并向下调节c-fos(另一种维持上皮命运的AP-1家族蛋白),导致EMT的激活和乳腺肿瘤的开始和转移。研究还表明,p18ink4c是GATA3的下游靶点,可以抑制乳腺上皮细胞(MEC)的增殖和肿瘤发生。(转化医学网360zhyx.com)
参考资料:
https://www.nature.com/articles/s41419-023-05888-9#Sec11
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发