【Cell子刊】华盛顿大学研究发现癌症转移代谢重编程新机制
| 导读 | 转移前壁龛形成是癌症转移扩散过程中的关键步骤。原发性肿瘤在未来转移部位引发宿主细胞的一种方式是通过血管纯粹流动导致肿瘤衍生的微粒脱落。然而,目前尚不清楚常驻免疫细胞对这些颗粒的吸收如何影响其表型和功能。 |
近日,华盛顿大学研究人员在《Cell Reports》发表研究论文“Uptake of tumor-derived microparticles induces metabolic reprogramming of macrophages in the early metastatic lung”,研究发现一种机制,通过该机制,摄取肿瘤衍生的微粒诱导巨噬细胞的重编程,以塑造它们在早期转移性肺中的命运和功能。

https://www.cell.com/cell-reports/fulltext/S2211-1247(23)00593-4#%20
研究背景
转移性扩散是癌症死亡的主要原因之一。然而,癌细胞从原发肿瘤播散并成功定植到远处器官的机制在很大程度上仍然未知。越来越多的证据表明,免疫细胞通过创造支持未来传入癌细胞的定植和生长的“转移前生态位”,在启动远处器官方面起着关键作用。这部分是由经典的炎性单核细胞和巨噬细胞介导的,通过调节组织重塑、血管生成和抑制抗肿瘤T细胞反应来促进癌症的转移性扩散。相反,一组非经典巡逻单核细胞通过吞噬肿瘤衍生物质和促进自然杀伤(NK)细胞募集和活化来防止肺转移的形成。肿瘤衍生因子在这些远处(转移前)部位指导骨髓细胞的机制仍未被发现。
研究进展
为了研究抗原加载的动力学以及它如何影响早期转移性肺中骨髓群体的命运,我们利用动物模型通过静脉内(IV)施用一系列标记有荧光标记物ZsGreen的已建立癌细胞系进行实验转移。与之前的结果一致,我们在静脉注射癌细胞后24小时在肺部的不同骨髓群体中发现了多种ZsGreen抗原负载。其中,非肺泡炎性巨噬细胞是摄取ZsGreen微粒的最主要细胞类型,占暴露后50小时所有ZsGreen CD45免疫细胞的∼24%。与注射的B45ZsGreen细胞相比,ZsGreen CD16细胞显示出较低的平均荧光强度,这表明与吞噬的完整肿瘤细胞相比,大多数摄入的肿瘤来源物质由较小的微粒组成。这种负载在注射ZsGreen标记的刘易斯肺癌(LLC),转移性差的B16F1以及源自β-肌动蛋白的非癌性ZsGreen标记小鼠胚胎成纤维细胞(MEF)后类似地发生。相反,静脉注射荧光乳胶珠后,巡检单核细胞代表了大多数磁珠摄取免疫细胞。
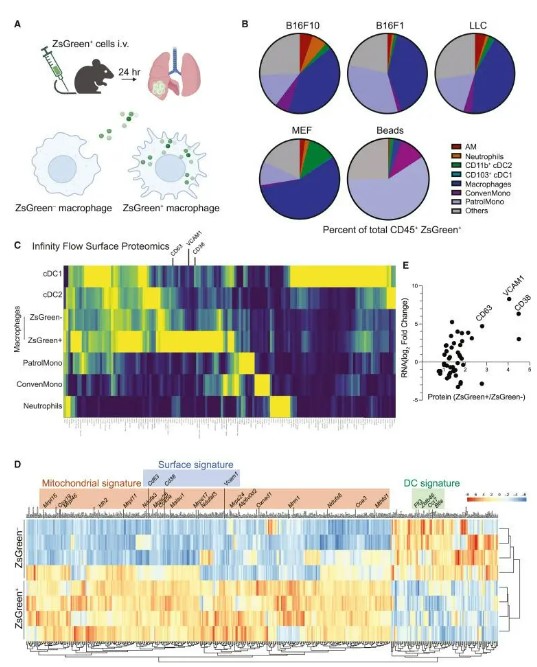
摄入肿瘤来源的微粒诱导早期转移性肺中巨噬细胞的转录重编程
接下来,我们试图确定基因和细胞表面蛋白表达在摄入肿瘤衍生微粒后是否受到调节。我们静脉注射了标记有ZsGreen(B16ZsGreen细胞)的B10F16细胞,24小时后,使用我们最近开发的Infinity Flow方法对整个肺进行了细胞表面蛋白质组学研究。我们全面检查了肿瘤摄入与非摄入巨噬细胞亚群的细胞表面蛋白质组,并基于高ZsGreen平均荧光强度(MFI)鉴定肿瘤摄取巨噬细胞群与其他肺髓样亚群进行了直接比较。我们还利用荧光激活细胞分选(FACS)来分离摄入肿瘤衍生微粒(ZsGreen)的肺巨噬细胞和没有摄入(ZsGreen)的肺巨噬细胞,并进行RNA测序以评估两个巨噬细胞群体之间的基因表达差异。对差异表达基因(DEGs)的分析显示,微粒的摄取诱导了快速转录重编程,其特征在于一系列线粒体基因(称为“线粒体特征”)以及细胞粘附标记物(例如,Vcam1,Cd38,Cd63)。重要的是,这种细胞表面特征与无限流揭示的特征一致。此外,我们发现刺激性树突状细胞(DC)基因(包括Flt3,Zbtb46,Ccr7和Btla)的表达在ZsGreen与ZsGreen中显著下调。
总之,这些数据表明,与早期转移性肺中的非负荷巨噬细胞相比,加载肿瘤衍生微粒的巨噬细胞显示出不同的转录和表型程序。
研究意义
总之,本研究表明巨噬细胞摄入肿瘤衍生的微粒诱导快速代谢和表型转换,其特征在于线粒体质量和功能增强,氧化磷酸化增加,粘附分子上调,导致早期转移肺的运动性降低。这种重编程事件依赖于通过mTORC1的信号传导,而不是mTORC2途径,并且由肿瘤衍生微粒的摄取诱导。这些数据支持一种机制,通过该机制,摄取肿瘤衍生的微粒诱导巨噬细胞的重编程,以塑造它们在早期转移性肺中的命运和功能。(转化医学网360zhyx.com)
参考资料:
https://www.cell.com/cell-reports/fulltext/S2211-1247(23)00593-4#%20
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发