【Cancer Cell】重磅!同济大学发现结直肠肿瘤抑制新机制 提出靶向治疗癌症新策略
| 导读 | 导读:环GMP-AMP合成酶(Cyclic GMP-AMP synthase, cGAS)是细胞质DNA的主要传感器,激活I型干扰素信号,在抗肿瘤免疫中发挥重要作用。然而,目前尚不清楚cGAS介导的抗肿瘤活性是否受营养状况的影响。 |
近日,同济大学王平及方兰共同在《Cancer Cell》 发表了题为“Methionine restriction promotes cGAS activation and chromatin untethering through demethylation to enhance antitumor immunity”的研究论文,该研究报告了甲硫氨酸剥夺通过阻断cGAS甲基化来增强cGAS活性,甲基化是由甲基转移酶SUV39H1催化的。
该研究进一步表明甲基化以UHRF1依赖的方式增强cGAS的染色质隔离。阻断cGAS甲基化可增强cGAS介导的抗肿瘤免疫并抑制结直肠肿瘤发生。临床上,人类癌症中cGAS甲基化与不良预后相关。因此,该研究结果表明,营养应激通过可逆甲基化促进cGAS激活,并提出了靶向cGAS甲基化治疗癌症的潜在治疗策略。

https://www.cell.com/cancer-cell/fulltext/S1535-6108(23)00173-3
研究背景
01
细胞质DNA是一种危险信号,被环状GMP-AMP合成酶(cGAS)感知,产生第二信使cGAMP,从而激活STING(也称为MITA、ERIS和MPYS)- tbk1 - irf3 -I型干扰素(IFN)通路。cGAS-STING通路在先天免疫应答和肿瘤免疫中发挥重要作用。通过各种方法(如放疗或化疗)激活cGAS-STING通路,已被视为与免疫检查点抑制剂(ICIs)和其他免疫肿瘤药物联合使用的一种有希望的策略。
cGAS最初被发现定位于细胞质中,在那里它直接与细胞质双链DNA (dsDNA)结合。与DNA结合促进cGAS液相分离和寡聚化,在此过程中cGAS被激活并产生cGAMP。大多数内源性cGAS也富集在细胞核中,其活性受到染色质系缚和细胞周期依赖性磷酸化的抑制。生物化学和结构研究表明,核小体通过将cGAS拴在组蛋白的酸性斑块上并阻断其与染色质DNA的结合来抑制cGAS的活性。然而,染色质隔离的cGAS是否以及如何被解除束缚和重新激活仍不清楚。
营养膳食调节,特别是氨基酸限制,已经成为一种重新编程肿瘤微环境的方法,并有望用于癌症治疗。癌细胞有很高的代谢需求,并与免疫细胞竞争氨基酸资源。肿瘤的内在机制和肿瘤微环境中的代谢调节也可能导致免疫逃逸或免疫应答降低。但目前尚不清楚氨基酸代谢是否对肿瘤固有的cGAS-STING信号传导有任何影响,以及是否可以与电离辐射(IR)和ICIs联合治疗癌症。
研究过程
02
为了研究氨基酸是否调节cGAS-STING通路,研究人员在全氨基酸缺失的培养基中培养小鼠癌细胞,通过检测STING (pSTING)和TBK1 (pTBK1)的磷酸化水平以及Ifnb1的表达来监测cGAS-STING的激活。数据显示,氨基酸剥夺增强了鲱鱼睾丸DNA (HT-DNA)刺激的cGAS-STING通路的激活。接下来研究人员发现甲硫氨酸剥夺以 cGAS 依赖性方式增强了 STING/TBK1 磷酸化和Ifnb1表达。相比之下,cGAMP 诱导的 STING/TBK1 激活不受甲硫氨酸剥夺的影响。
HT-DNA 或 IR 对 cGAS 的激活减少了 mK350 甲基化,表明 cGAS 甲基化与和可能负相关抑制 cGAS 激活。为了测试这种可能性,研究人员将 hK362 cGAS 替换为精氨酸 (R) 以阻断甲基化,或替换为甲硫氨酸 (M) 以模拟单甲基化。
赖氨酸甲基化通常由赖氨酸甲基转移酶 (KMT) 催化。为了鉴定 cGAS 甲基化所需的酶,我们为 80 种已知和推定的 KMT 生成了单独的敲除细胞系,并发现Suv39h1敲除减少了 cGAS 甲基化。
研究人员接下来检查了 SUV39H1 是否影响 cGAS 活动。之后探讨了甲基化影响 cGAS 活性的潜在机制。为了测试 cGAS 甲基化促进的染色质束缚是否依赖于 cGAS-组蛋白的酸性斑块相互作用,研究人员生成了一个 cGAS R255E 突变体,由于未知原因,该突变体已被证明会削弱但并未完全消除 cGAS 与染色质的束缚。
研究人员接下来检查了 UHRF1 是否影响 cGAS 染色质隔离。当 UHRF1 与 H3K9me2/me3 和半甲基化 DNA 相互作用时,研究人员还检查了 cGAS 染色质隔离是否受组蛋白或 DNA 甲基化的影响。
研究人员接下来探讨了 SUV39H1-cGAS 轴在肿瘤生长中的潜在病理作用。数据表明靶向 SUV39H1-cGAS 轴可以提高放疗的疗效。
cGAS 对于 ICI 的抗肿瘤作用至关重要。总之,数据表明 SUV39H1 抑制或 DMR 与抗 PD-1 或放疗的组合具有潜在的癌症治疗临床应用。
宿主 cGAS-STING 通路对于限制肿瘤生长也是必不可少的。数据表明宿主Suv39h1缺陷也可以增强抗肿瘤免疫力。研究还发现Cgas K350R或K350M小鼠的肿瘤生长速度比野生型小鼠快,同时肿瘤中的免疫细胞浸润减少。此外,在 AOM/DSS 模型中, K350R或K350M小鼠比野生型小鼠长出更多肿瘤,对体重没有显著影响。
通过分析包含 108 个患者样本的结直肠癌组织阵列,研究人员发现高 cGAS 甲基化与KRAS/NRAS G12/13 相关,但与BRAF V600E 突变和 P53 表达无关。低 cGAS 甲基化与错配修复蛋白 MLH1、MSH6 和 PMS2 的低表达相关,并且与 MSI-H 显著相关,提示cGAS甲基化与微卫星稳定呈正相关。
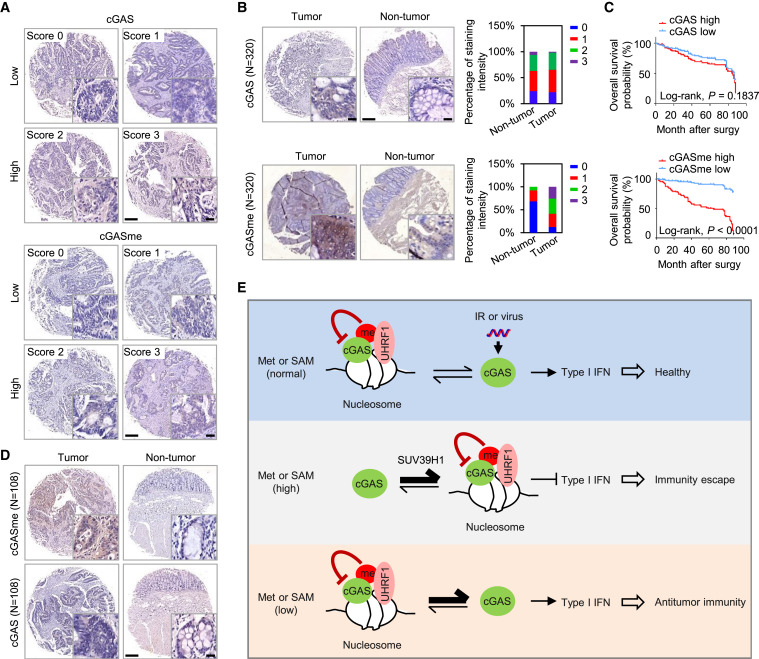
cGAS甲基化与结直肠癌呈正相关
研究意义
03
综上,研究人员提出靶向Suv39h1-cGAS轴联合放疗和免疫检查点阻断可能是一种新的癌症治疗策略。(转化医学网360zhyx.com)
参考资料:
https://www.cell.com/cancer-cell/fulltext/S1535-6108(23)00173-3
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发