再取进展!中科院研究人员揭示了 PPDPF 调控胰腺导管腺癌的新机制
| 导读 | 胰腺癌是全球癌症死亡的第六大常见原因。胰腺导管腺癌(pancreaticductaladenocarcinoma,PDAC)约占胰腺癌的95%以上。PDAC患者5年总生存率不到5%。虽然手术是有效延长PDAC患者生存时间的唯一治疗手段,但肿瘤手术切除患者的5年生存率仍低于25%。尽管人们对胰腺癌的机制认识有了实质性的提高,但目前胰腺癌的治疗方法仍然非常有限。 |
近日,上海营养与健康研究所谢东课题组研究揭示了胰腺祖细胞分化增殖因子(PPDPF)在胰腺导管腺癌(PDAC)发生发展中的重要作用,并提供了一种针对胰腺导管腺癌的潜在治疗策略。相关论文发表在《Advanced Science》上。

https://onlinelibrary.wiley.com/doi/10.1002/advs.202202448
研究背景
PPDPF 首次在斑马鱼中被报道。它是一种外分泌细胞调节剂,具有潜在的 PDZ、SH2、SH3 结构域结合位点和一个 GTP 结合位点。PPDPF 在胰腺癌中的生物学功能仍然未知。
RAS基因是人类癌症中最常发生突变的致癌基因。PDAC患者中98%的KRAS发生突变,其中G12位点突变占KRAS突变的97%。SOS1是RAS的一个重要的鸟嘌呤核苷酸交换因子,通过将RAS结合的GDP转换为GTP,从而激活RAS。EGF激活EGFR后,SOS1被招募到细胞膜上,并催化RAS结合的GDP-GTP交换。CDC25和REM结构域是SOS1的核心结构域(合称为Cat结构域),发挥催化功能。REM结构域包含一个能够与RAS-GTP结合的激活异构位点。该位点结合RAS-GTP后,可进一步激活负责催化的CDC25结构域,进而促进RAS的GDP-GTP交换。SOS1的GEF活性受到不同机制的调控,包括SOS1的膜定位、自抑制及MAPK对SOS1的C端结构域的磷酸化等。之前的研究显示GEF可以结合GTP。然而,目前对于GEF结合GTP的意义,以及SOS1是否能够结合GTP知之甚少。
研究进展
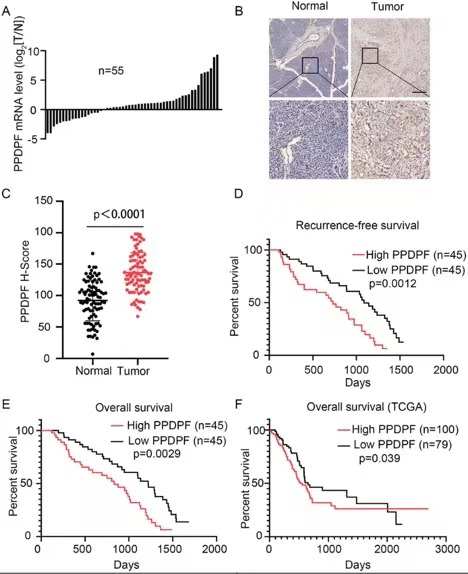
为了确定 PDAC 中 PPDPF 的表达模式,研究人员使用 RT-qPCR 检测 PDAC 组织和匹配的邻近非癌组织中 PPDPF 的 mRNA 水平。与其对应物相比,PPDPF mRNA 水平在 67.3% (37/55) 的 PDAC 组织中上调。为了进一步证实 PDAC 中 PPDPF 的表达模式,组织微阵列用针对 PPDPF 的抗体染色。与 RT-qPCR 的结果一致,与成对的非癌组织相比,PPPDF 表达在肿瘤组织中显著增加。对 PPDPF 表达与 PDAC 患者生存率之间关系的分析表明,高 PPDPF 表达与较差的无复发生存率和总生存率相关。
研究意义
总的来说,研究发现PPDPF在胰腺癌中的表达显著升高,PPDPF高表达的患者预后较差。在胰腺导管腺癌小鼠模型中敲除Ppdpf显著抑制Kras突变驱动的PDAC的发生发展。此外,研究人员还证明了PPDPF可以结合GTP,并将GTP提供给SOS1,从而增强其GEF活性,促进KRAS的活化。该项研究揭示了PPDPF在PDAC中的新功能和KRAS活化调控的新机制,为PDAC提供了一个潜在的治疗靶点。(转化医学网360zhyx.com)
参考资料:
https://medicalxpress.com/news/2022-12-reveal-role-ppdpf-mutant-kras-driven.html
https://onlinelibrary.wiley.com/doi/10.1002/advs.202202448
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发