【Science】国际关注!陈子江院士团队发表人类早期胚胎翻译组图谱,揭示生命初期关键机制
| 导读 | 多年来,陈子江院士团队致力于生殖发育与子代健康的临床与基础研究,取得一系列原创性成果。其中,多项原创性成果发表于Science、Nature、Cell、The New England Journal of Medicine、The Lancet等国际顶级学术期刊。 |
9月8日,山东大学生殖医学研究中心陈子江院士、赵涵教授团队联手清华大学颉伟教授团队,发现了人类早期胚胎翻译调控新机制,以长文形式在《Science》发表题为“ Translatome and transcriptome co-profiling reveals a role of TPRXs in human zygotic genome activation ”的文章。

https://www.science.org/doi/10.1126/science.abo7923
早期胚胎发展的关键机制
研究团队结合超灵敏翻译组测序技术(Ribo-lite)和转录组测序技术(Smart-seq2),开发出一项可以进行翻译组与转录组联合测序的新技术——Ribo-RNA-lite(简称R2-lite)。利用此技术,研究团队发现,一组同源域(Homeobox)转录因子在人类合子基因组激活阶段附近呈现高翻译活性,这些转录因子包括母源因子TPRXL以及在初级ZGA时期开始表达的TPRX1和 TPRX2。它们潜在的DNA结合基序在ZGA基因的远端开放染色质区域(即可能的增强子)上高度富集。因此,这些转录因子可能就是ZGA过程的关键调控因子。也就是说,这项研究揭示了人-鼠早期胚胎翻译组动态变化的差异性和保守性,并且鉴定出了人类ZGA过程的关键调控因子TPRXL、TPRX1和 TPRX2。
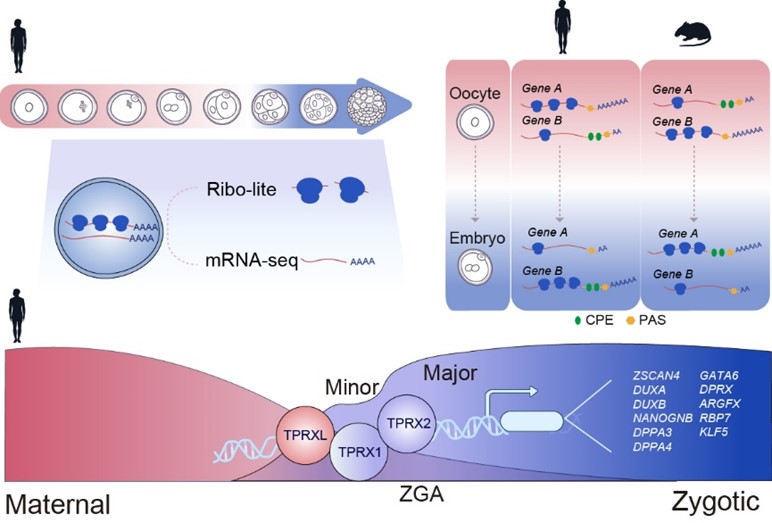
该研究绘制了人类卵子向早期胚胎转变过程中的翻译图谱,通过观察,研究人员发现了一组重要的调控人类合子基因组激活和早期胚胎发育的关键转录因子,并首次报道了人类与小鼠在卵子向早期胚胎转变过程中,翻译水平动态变化存在物种差异。该研究为人类早期生命探索、胚胎质量评估、生殖疾病研究提供了新方向,为提高生殖健康水平和预防出生缺陷奠定了重要基础。
PGT-A研究
2022年4月,陈子江院士团队在《The New England Journal of Medicine》发表的临床研究成果“Live birth with or without preimplantation genetic testing for aneuploidy(胚胎植入前非整倍体遗传学检测对累积活产率的影响)”,在国际上引发了对胚胎植入前非整倍体筛查(PGT-A)技术有效性和安全性的持续关注和广泛讨论。与此同时,美国国立卫生研究院生殖生物学和医学科主任、美国生殖医学学会前任主席Alan H. DeCherney教授和该团队针对本研究主要结局指标(累积活产率)、人群选择、嵌合体移植以及PGT-A适用范围等方面进行了深入交流和讨论。
陈子江团队取得的成果证实了,增加PGT-A筛选胚胎后的累积活产率低于常规IVF的累积活产率,因而PGT-A技术应谨慎应用,并明确其适用范围。此外,本研究发现PGT-A可以降低流产风险,意味着PGT-A在流产风险较高人群中可能更有应用价值,但目前PGT-A的应用指征在国际上尚缺乏充分的循证医学证据,陈教授团队在国际上首次开展了评价该项技术的RCT研究,将来需要设计更多的科学的多中心、大样本的临床研究进一步探讨该技术的有效性、安全性和实用性。
原始生殖细胞发育新机制
2022年8月,山东大学生殖医学研究中心陈子江院士团队在《Proceedings of the National Academy of Sciences》(美国国家科学院院刊PNAS)杂志上发表了最新研究成果“Transcription-replication conflicts in primordial germ cells necessitate the Fanconi anemia pathway to safeguard genome stability”。
生殖细胞是遗传物质传递的载体,在发育过程中可维持高度的基因组稳定性。原始生殖细胞(primordial germ cells,PGC)的快速增殖是生殖储备建立的基础,但目前对PGC的基因组稳定性维持机制尚不清楚。
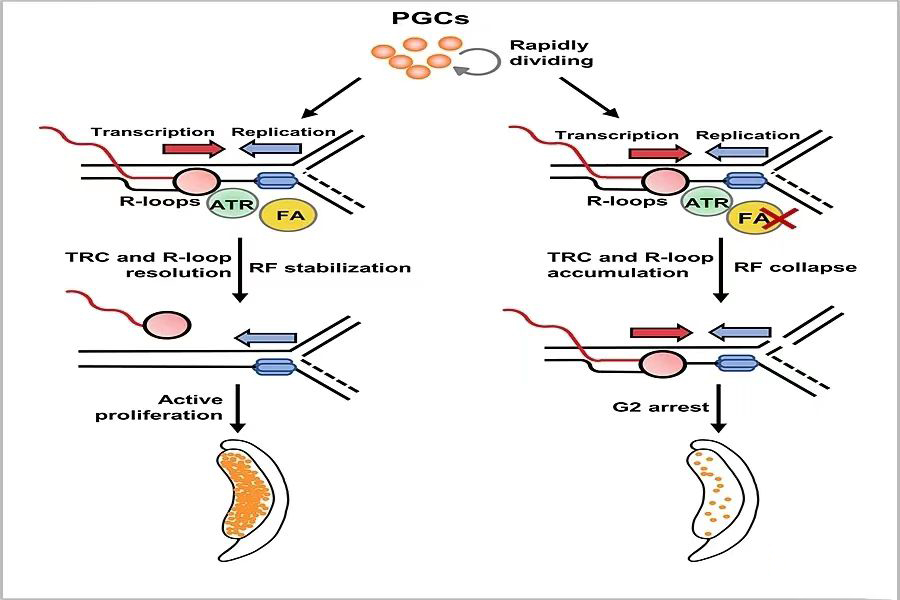
该研究首次发现PGC中存在高频率转录-复制冲突(transcription-replication conflicts,TRC),TRC能够激活范可尼贫血(Fanconi anemia,FA)通路,通过稳定复制叉和解除R-loop有效应对TRC,从而维持PGC的快速增殖。FA通路失活则导致TRC解除障碍和R-loop聚集,DNA损伤增加,进而激活p53通路引起PGC增殖障碍,最终引起不孕不育。该研究为FA患者的生育障碍提供了新的机制解释,同时也为生殖细胞基因组稳定性维持机制研究提供了新的方向。(转化医学网360zhyx.com)
参考资料:
https://www.view.sdu.edu.cn/info/1003/168969.htm
https://www.view.sdu.edu.cn/info/1021/168399.htm
https://www.view.sdu.edu.cn/info/1021/163954.htm
https://www.science.org/doi/10.1126/science.abo7923
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录








还没有人评论,赶快抢个沙发