【Cell子刊】具有里程碑意义的研究:病毒递送的CRISPR-Cas9感染肠道微生物证明了微生物组基因编辑的潜力!
| 导读 | 近日,发表在《 Cell Reports》杂志上的研究表明,研究人员使用DNA编辑系统CRISPR来改变小鼠肠道内细菌的基因组,这是哺乳动物肠道微生物群中第一个稳定的基因编辑。这项研究集中在大肠杆菌上,精确基因编辑在肠道微生物组中的一个有用应用是靶向大肠杆菌的有害菌株,同时保持有益的菌株不受干扰。他们使用一种名为M13的病毒将CRISPR-Cas9系统注入特定大肠杆菌菌株的细胞中,然后开始切割DNA片段。经过基因编辑后,目标菌株迅速开始消失。设想未来有朝一日,类似的方法也可以用于促进人类“好”的肠道细菌的生长,研究人员还需要扩大他们工具包中的病毒列表,并尝试如何改变微生物组的个体成员对整体细菌种群的影响。 |
加州大学旧金山分校的研究人员已经成功地使用了DNA编辑系统CRISPR来改变哺乳动物肠道内细菌的基因组,这一发展将促进我们对微生物组的理解,并最终为治疗肠道相关疾病铺平道路。
在本月发表在《 Cell Reports》杂志上的这项具有里程碑意义的研究中,研究人员能够从生活在小鼠肠道的大肠杆菌中去除大量基因,并改变遍布其消化系统的细菌群落的整体构成。研究人员发表了一篇题为“Phage-delivered CRISPR-Cas9 for strain-specific depletion and genomic deletions in the gut microbiome”的文章:

微生物学和免疫学教授Peter Turnbaugh博士说:“我们已经证明了哺乳动物肠道微生物群中第一个稳定的基因编辑。这是试图在肠道内设计细菌的起点。”
目前,想要改变肠道微生物的研究人员和医疗从业者的选择极其有限。例如,细菌性食物中毒和类似问题可以用广谱抗生素治疗,但这种药物最终会杀死许多“有益的”微生物和有害的。粪便移植也被用于为患有某些感染和胃肠道疾病的患者重新植入健康的微生物群。但是医生们不能确定引入的微生物是否能够超越患者现有的细菌群落,这意味着治疗并不总是成功的。
Turnbaugh表示,因此,改造消化系统中已经繁衍生息的细菌将是未来研究和治疗微生物组相关健康问题的关键途径。直接改变肠道内微生物的基因组将为微生物组治疗带来一种目前尚不可能达到的精确水平。
Turnbaugh还说:“能够改变已经存在于肠道中的微生物的DNA,可以让我们以一种比以前更可控的方式研究微生物组。这真的给了我们一个机会去了解一些关于健康和疾病的重要问题。”
Turnbaugh的研究集中在大肠杆菌上,大肠杆菌是一种自然存在于肠道中的细菌,但由于某些菌株可能导致食物中毒,因此名声不佳。精确基因编辑在肠道微生物组中的一个有用应用是靶向大肠杆菌的有害菌株,同时保持有益的菌株不受干扰。
在这项研究中,研究人员想知道他们是否可以使用基因编辑工具来定位和杀死一株大肠杆菌,同时单独留下另一株。Turnbaugh的团队使用一种名为M13的病毒将CRISPR-Cas9系统注入特定大肠杆菌菌株的细胞中,在那里它开始切割DNA片段。
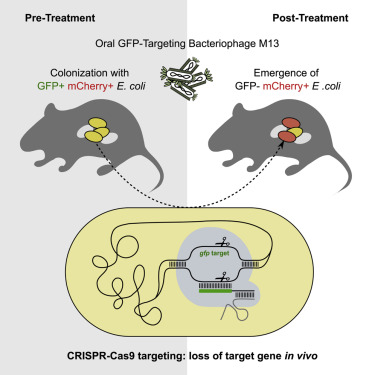
结果是戏剧性的。在引入CRISPR-Cas9系统之前,靶向菌株在实验中从小鼠收集的粪便样品中更突出。然而,经过基因编辑后,目标菌株迅速开始消失。两周后,它只占监测细胞群的1%。
该研究成功的关键是使用工程形式的M13,这是一种自然攻击大肠杆菌但通常不能在消化系统内存活的病毒。为了解决这个问题,Turnbaugh和他的同事将一个抗生素抗性基因拼接到M13将传递给感染细胞的DNA中,从而使病毒及其携带的CRISPR-Cas9系统更容易传播。
Turnbaugh设想有朝一日,类似的方法也可以用于促进人类“好”肠道细菌的生长。例如,如果研究人员对某些细菌菌株的基因进行编辑,以允许细菌以稀有营养素为食,那么一个人通过简单地向他们的饮食中添加大量这些营养素,就可以在一定程度上控制肠道中蓬勃发展的微生物混合物。他补充说,首先,研究人员需要扩大他们工具包中的病毒列表,并尝试如何改变微生物组的个体成员对整体细菌种群的影响。
Turnbaugh说:“梦想是你可以选择你的肠道中的哪些特定菌株,甚至只是你想要促进或淘汰的个体基因。我们真的很兴奋我们能在大肠杆菌中推动这一点,希望它能为肠道微生物群的其他成员带来类似的工具。”(转化医学网360zhyx.com)
参考资料:
https://medicalxpress.com/news/2021-11-infecting-gut-microbes-crispr-loaded-virus.html
注:本文旨在介绍医学研究进展,不能作为治疗方案参考。如需获得健康指导,请至正规医院就诊。
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发