【PNAS】高浓度二氧化碳为何引起焦虑?
| 导读 | 房间里逐渐蓄积的代谢物二氧化碳(CO2)是我们工作效率低下的元凶。 |

北有暖气南有空调,即使窗外大雪纷飞,室内依旧温暖如春,但房间里逐渐蓄积的代谢物二氧化碳(CO2)是我们工作效率低下的元凶。拥挤的办公室中的CO2浓度易高于1%,人会感到烦躁和心悸;密闭卧室中一晚蓄积的CO2浓度常高于2%,人会感到气喘、焦虑、睡不醒。实际上,空气中CO2含量仅为0.03%,在我们所处的环境中却高出几百倍!
焦虑和气喘是血管对高浓度CO2作出的自我保护机制,提示环境可能有潜在的危险;而这种脑血管响应性的丧失将导致一系列呼吸系统疾病和焦虑症的产生。

加州大学的Markus Schwaninger课题组近日在PNAS上发表工作,发现脑血管响应高浓度CO2点关键蛋白和通路,阐明了CO2引起特定呼吸模式和焦虑的机制。

CO2在血液缓冲体系中被迅速转化为氢离子和碳酸。CO2的许多生理效应都由氢离子介导,例如呼吸刺激和恐惧反应,并且氢离子能引起强烈的血管扩张而导致大脑灌注增加。这一现象的产生与G蛋白偶联受体有关,仅GPR4 和GPR68两种G蛋白表达在血管中。
因此研究者构建了这两种G蛋白基因敲除的动物,将其分别暴露在10%CO2环境中,发现CO2引发的前脑初代血管扩张效应在GPR4-KO小鼠中减弱了。CO2感受器应位于内皮细胞中,而原位杂交验证发现GPR68表达在血管平滑肌上,因此说明GPR4才是脑血管内皮细胞中响应CO2的关键蛋白。
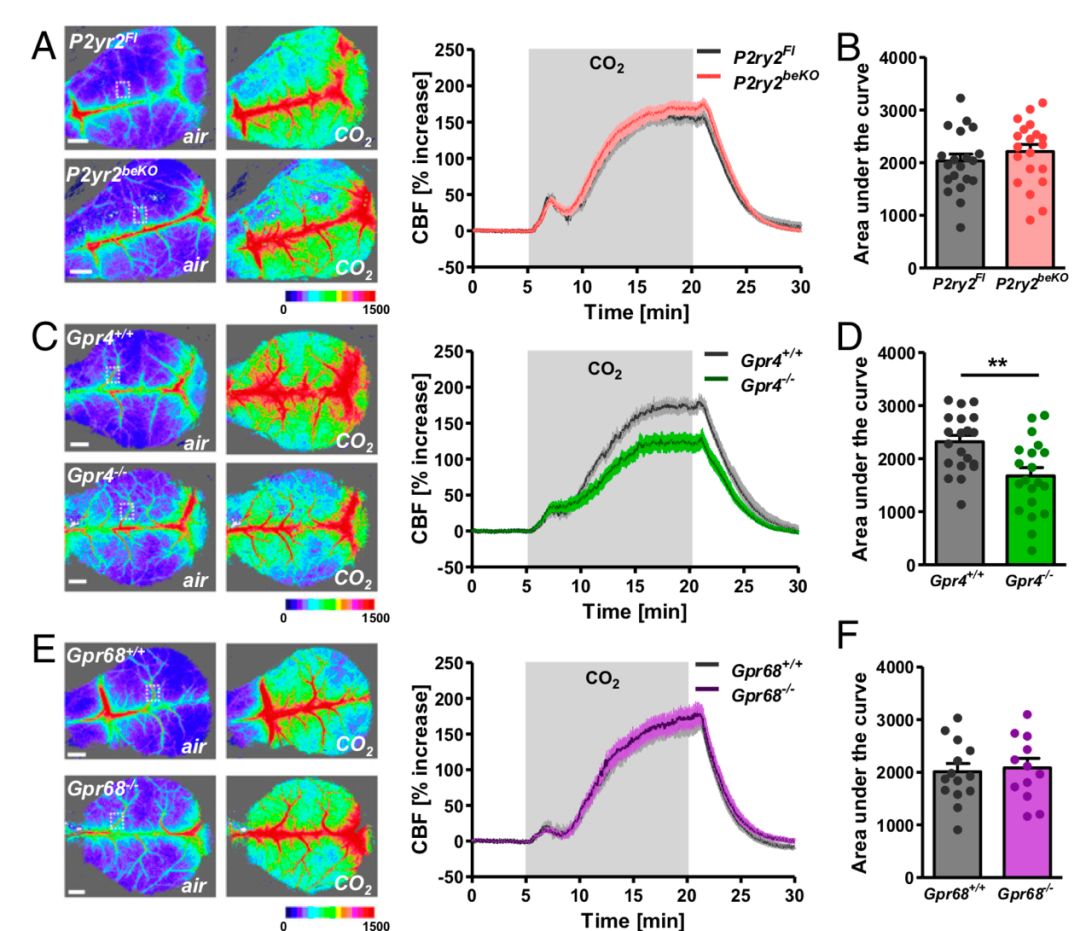
GPR4是脑血管中感受CO2的关键蛋白
进一步,研究者通过Gαq/11抑制剂,证明CO2/H+作用于内皮细胞的氢离子感受器GPR4 ,进而激活下游的Gαq/11蛋白以增加前列环素和一氧化氮的释放,从而促进脑血管的扩张。
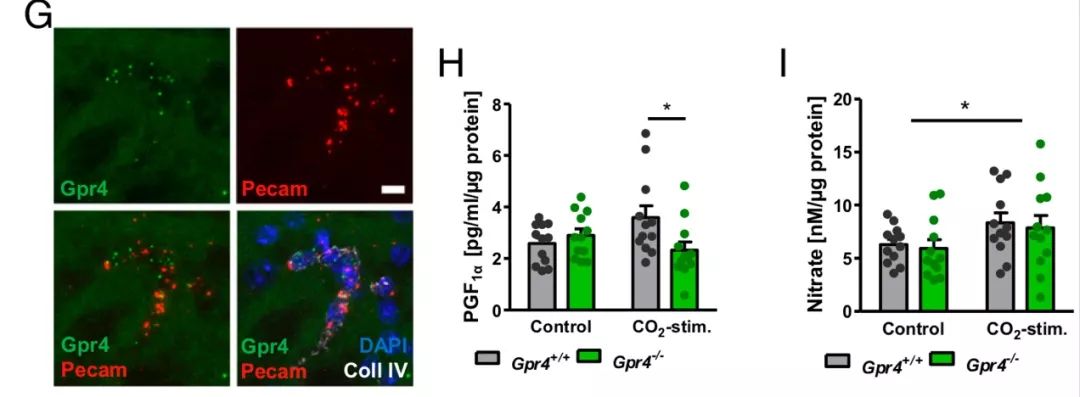
GPR4促进前列环素和一氧化氮释放
接下来,研究者们发现GPR4蛋白缺失后,脑血管对CO2的响应严重失常。正常小鼠暴露在高浓度CO2下,用MRI核磁共振能检测到脑灌注增加,离体脑片皮层的血管直径增加,但GPR4-KO小鼠则不会发生以上响应。
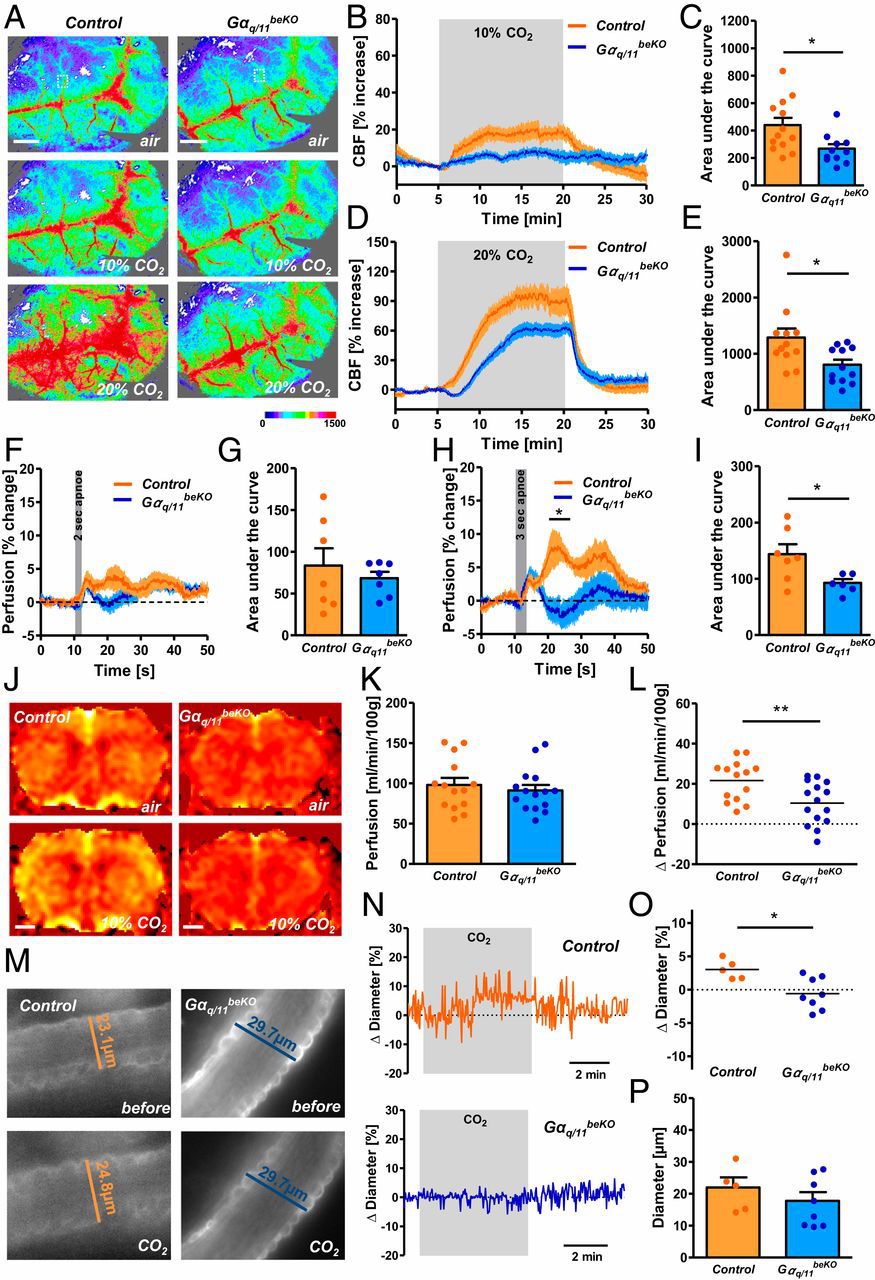
GPR4蛋白缺失导致脑血管对CO2的响应失常
当体内CO2浓度升高时,身体会发出窒息的预警,例如紧张不安、焦躁烦闷。前期在人类和啮齿类中的研究表明,高浓度CO2会激活大脑中主宰恐惧和惊慌的脑区——基底前脑杏仁核。
研究者发现,暴露在高浓度CO2环境中的对照组杏仁核灌注增加,而GPR4-KO小鼠无明显变化。在高浓度CO2环境或正常环境下,GPR4-KO小鼠均表现出更多的“惊呆”行为,说明其始终表现出更高的恐惧反应;GPR4-KO小鼠在旷场实验中贴壁运动更多,在高架十字迷宫的开臂中运动时间更短,更倾向于待在安全范围内而不对陌生环境进行探索,说明GPR4蛋白的缺失增加小鼠基础状态下的焦虑反应。
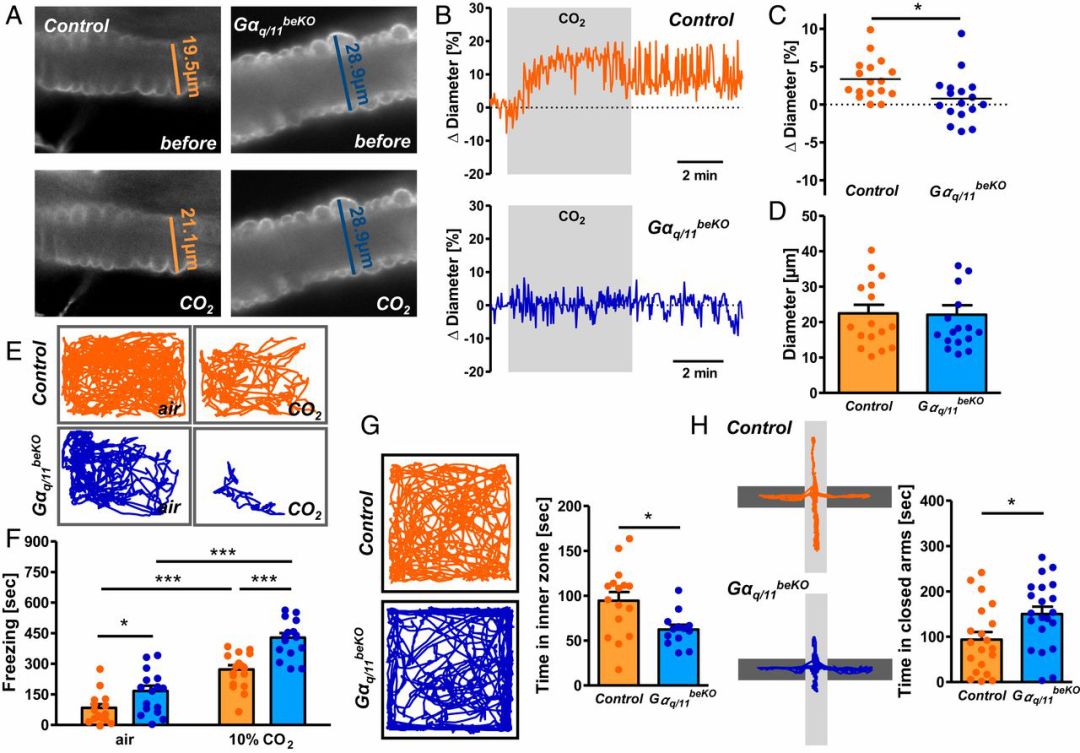
GPR4蛋白缺失使小鼠更焦虑
(图G旷场实验,小鼠在空旷新环境中运动到中心区域代表探索行为,紧贴墙壁代表紧张焦虑:图H高架十字迷宫实验,在高处的交叉通道,仅黑色通道(闭臂)有围栏,通过统计小鼠到开臂上探索的时间,评价其焦虑水平。图中显示小鼠的运动轨迹。)
二氧化碳作用于脑干不同区域增加呼吸频率和潮气量。研究者发现脑干的梯形后核(RTN)有GPR4表达。与皮层和杏仁核的灌注结果相反,高浓度CO2环境引起正常小鼠的RTN血管收缩,刺激呼吸反应增强,并重启类似窒息的呼吸暂停;而GPR4-KO小鼠呼吸减弱,呼吸暂停时间延长。脑血管反应性受损会使患者易产生呼吸暂停发作,这与糖尿病或肥胖症等疾病的呼吸并发症相似。
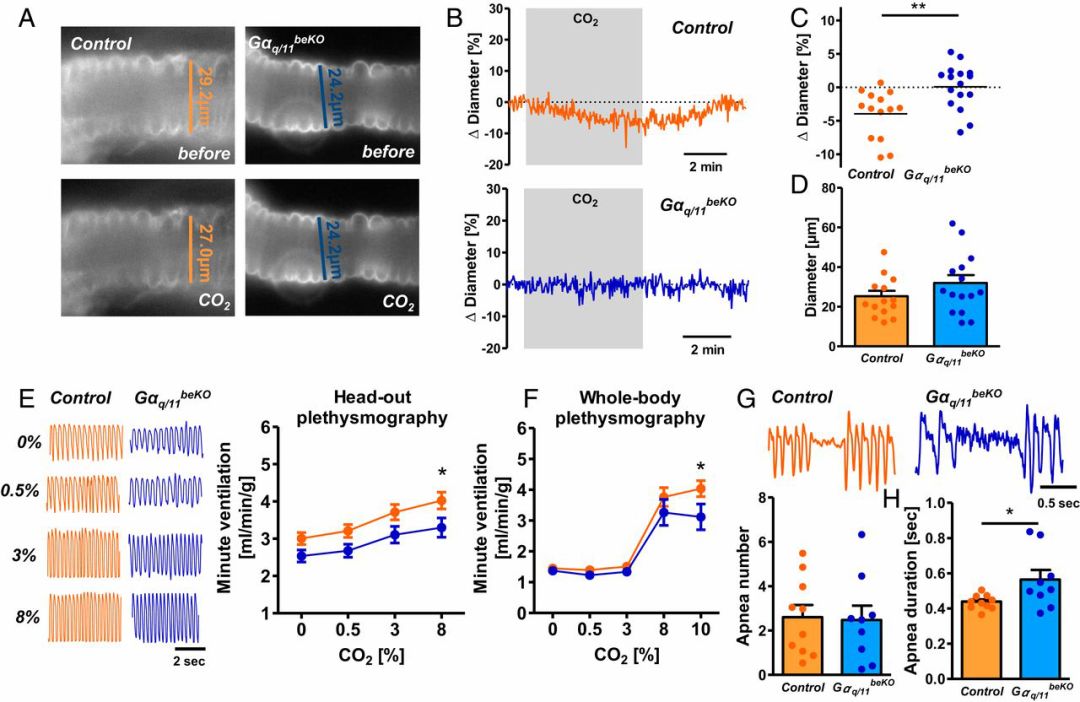
GPR4蛋白缺失使小鼠对高浓度CO2环境呼吸代偿紊乱
这项研究阐明了脑血管的二氧化碳反应性是由关键蛋白GPR4介导并激活下游Gαq/11所产生的,在不同脑区产生的作用效应不同,引发了高浓度二氧化碳下的焦虑和特殊呼吸模式。GPR4蛋白功能受损导致的脑血管反应性减弱,是内皮功能障碍诊断的关键特征,有望作为睡眠呼吸暂停、焦虑症和相关的代谢综合征并发症等治疗新靶标!(转化医学网360zhyx.com)
参考文献:
Jan Wenzel, et al. Impaired endothelium-mediated cerebrovascular reactivity promotes anxiety and respiration disorders in mice. PNAS, 02 Jan, 2020.
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发