“饿死”胰腺癌——双管齐下,“癌王”能否束手就擒?
| 导读 | 快速增殖的胰腺癌细胞需要生物大分子提供能量和生物合成基础,因此细胞营养限制成为了治疗胰腺癌的潜在策略,其中利用L-天冬酰胺酶抑制天冬酰胺的疗法受到广泛关注。 |
胰腺癌是一种恶性程度很高的消化道胰腺癌,诊断和治疗均极为困难,5年生存率<1%,是预后最差的恶性胰腺癌之一。快速增殖的胰腺癌细胞需要生物大分子提供能量和生物合成基础,因此细胞营养限制成为了治疗胰腺癌的潜在策略,其中利用L-天冬酰胺酶抑制天冬酰胺的疗法受到广泛关注。但是该方法在胰腺癌治疗中的应用效果与预期相去甚远,而解决方案尚未有定论。
近日,美国Sanford Burnham Prebys的研究人员发现L-天冬酰胺酶作用于胰腺癌后,癌细胞可通过激活MAPK通路改写代谢途径,提供天冬酰胺保证癌细胞的增殖发展。同时他们指出在L-天冬酰胺酶与MAPK抑制剂的双强联合下,“癌王”或将束手就擒。

天冬酰胺——屡禁不止的癌细胞“生命之源”
胰腺癌的生长和代谢与某些特殊氨基酸含量息息相关。谷氨酰胺和天冬酰胺是两个影响胰腺癌细胞发育的关键营养物,这两种氨基酸是胰腺癌细胞蛋白质合成的基础之一,可以增加抗氧化应激,还为三羧酸循环提供原料,同时产生ATP并合成核苷酸、氨基酸、脂质的前体,是动物细胞最重要的氮源提供单位,对于胰腺癌细胞的生长增殖至关重要。
在没有外源谷氨酰胺的条件下,胰腺癌细胞可以从头合成谷氨酰胺,但不能从头合成天冬酰胺。而且有研究指出,谷氨酰胺缺乏的情况下,天冬酰胺可以填补部分空白继续维持胰腺癌细胞的生长发育,反之则无法实现。也就是说,对胰腺癌细胞而言,缺谷氨酰胺或许尚有一线生机,若缺乏天冬酰胺,那么胰腺癌细胞就会被“活活饿死”。天冬酰胺是胰腺癌细胞重要的“生命之源”,而抑制天冬酰胺水平或许正是抑制胰腺癌生长的重要步骤。
可是,理想很丰满现实很骨感,研究人员在胰腺癌小鼠上应用了天冬酰胺抑制剂——L-天冬酰胺酶,却发现癌细胞非但没有被杀死,反而活跃依旧,而小鼠肿瘤组织中的天冬酰胺水平与治疗前相比并未有太多波动。也就是说,L-天冬酰胺酶应用后,有另外一条途径“补足”了胰腺癌细胞中的天冬酰胺,才让癌细胞继续我行我素。这条途径是什么呢?
MAPK通路——癌细胞另一“食物来源”
研究人员发现,在胰腺癌细胞中,L-天冬酰胺酶引起的天冬酰胺限制激活了一条重要通路——MAPK通路。这条通路的活化增强了MNK1(丝裂原活化蛋白激酶相互作用激酶1)、eIF4E(真核翻译起始因子)的翻译,MNK1和mTORC1可协同增加ATF4 (激活转录因子4)的翻译,而ATF4的靶基因正是天冬酰胺合成的关键酶——ASNS(天冬酰胺合成酶)!换言之,天冬酰胺抑制剂发挥作用抑制天冬酰胺代谢途径的同时启动了天冬酰胺的合成通路,MAPK通路成了胰腺癌细胞的另一“食物来源”,胰腺癌细胞中的天冬酰胺自然有增无减。
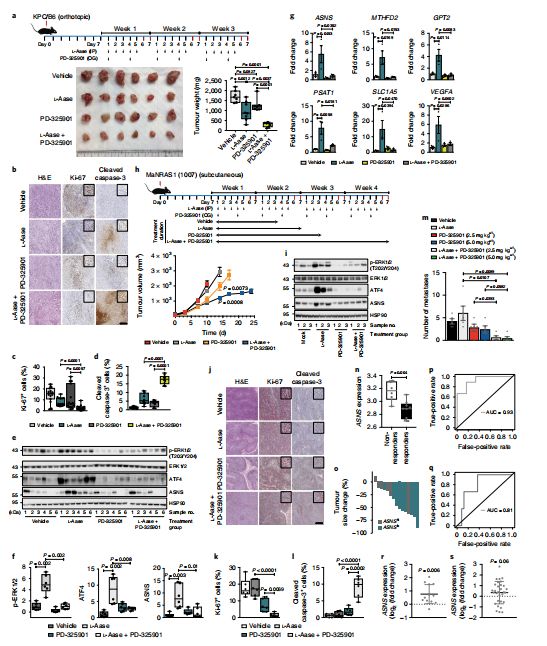
同时抑制天冬酰胺代谢途径和MAPK通路可抑制胰腺癌发展
这就意味着,传统的天冬酰胺抑制剂需要一个“帮手”才能对胰腺癌围追堵截,那就是MAPK抑制剂。研究人员指出,抑制MAPK通路能够破坏ATF4及ASNS的上调,使肿瘤细胞对天冬酰胺限制更加敏感,从而使细胞生长显著受限,双管齐下,有望让胰腺癌无处可逃。而ASNA的低表达和较低的MAPK活性与良好的预后明显相关,这也提示这二者或有望成为胰腺癌的预后指标。
这项研究为同时靶向MAPK和天冬酰胺代谢途径的癌症治疗方案提供了理论依据,也为广大胰腺癌患者提供了一个控制肿瘤发展的新希望。而这些理论能对临床产生多大效益,我们拭目以待。(转化医学网360zhyx.com)
参考文献:
Gaurav Pathria,et al.Translational reprogramming marks adaptation to asparagine restriction in cancer.Nature Cell Biology (2019).
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发