Science子刊:原来是这个激酶一手策划了乳腺癌转移!
| 导读 | 近年来,乳腺癌已经成为危害全球女性健康的第一大杀手,其发病率有逐年上升和年轻化的趋势。转移是乳腺癌的致死性进展,一旦发生即可严重降低患者生存率并对患者预后产生恶性影响。目前,乳腺癌发生发展的分子机制尚未详尽得知,但细胞信号传导通路的异常激活应与其密切相关。 |

近年来,乳腺癌已经成为危害全球女性健康的第一大杀手,其发病率有逐年上升和年轻化的趋势。转移是乳腺癌的致死性进展,一旦发生即可严重降低患者生存率并对患者预后产生恶性影响。目前,乳腺癌发生发展的分子机制尚未详尽得知,但细胞信号传导通路的异常激活应与其密切相关。
近日,Stowers医学研究所的研究人员发现了乳腺肿瘤激酶(BRK)对SMAD4的抑制作用,同时明确该通路激活是导致乳腺癌转移的关键因素,为乳腺癌新型治疗方法的研发开辟了一条潜在道路。

SMAD4——将乳腺癌拒之门外的“守门员”
我们知道,转化生长因子(TGF-β)通路是与乳腺癌发生发展关系最为密切的信号通路之一。TGF-β信号通路在乳腺癌发生早期能够抑制细胞增殖并促进细胞凋亡,然而,随着肿瘤恶性程度的增加,TGF-β逐渐表现为促进肿瘤的进展和转移,这就是“TGF-β悖论”,但该悖论存在的具体机制尚不得而知。
随着对TGF-β下游重要信号分子的进一步深入研究,人们发现一类细胞内信号转导分子——SMAD4或许是解释这个悖论的关键。SMAD4是TGF-β信号的重要胞浆内信号级联分子,其可以自身形成同源复合物或与其他激活型SMAD家族成员形成异源复合物并转移到细胞核内,在其他转录因子的协同作用下调节TGF-β应答基因的转录。在SMADS家族中,只有SMAD4是公共介体,SMADS的所有生物效应都是SMAD4与其他SMAD蛋白相互作用的结果。有研究指出,TGF-β/SMAD4组成了一个肿瘤抑制通路,该通路可以抑制乳腺癌细胞的增殖,SMAD4是该通路的关键蛋白。一旦SMAD4的表达降低,就可影响TGF-β/SMAD4通路中正常信号的传递并启动异常信号传导,导致上皮细胞的过度增生和分化异常,引发上皮间充质转化(EMT),最终导致乳腺癌的发展与转移。既然知道了是SMAD4表达降低引发了“TGF-β悖论”,那么下一个要解决的问题就是,谁限制了SMAD4表达?
BRK——锚定并压制“守门员”的幕后黑手
研究人员分析了大量TGF-β/SMAD4通路的相关分子,一种在超过85%的乳腺癌组织中存在的激酶——BRK引起了他们的注意。BRK是一种非受体酪氨酸激酶,可通过促进Akt的活化来增强EGF的促有丝分裂信号,也可在各种EGF受体配体的刺激下活化,进而增加肿瘤细胞增殖和迁移。同时,BRK还可以促进HER2诱导的肿瘤发生。BRK是标准的肿瘤促进因子,其活化是多种肿瘤发生发展的关键。那么,它的活化与SMAD4受抑制是否相关呢?
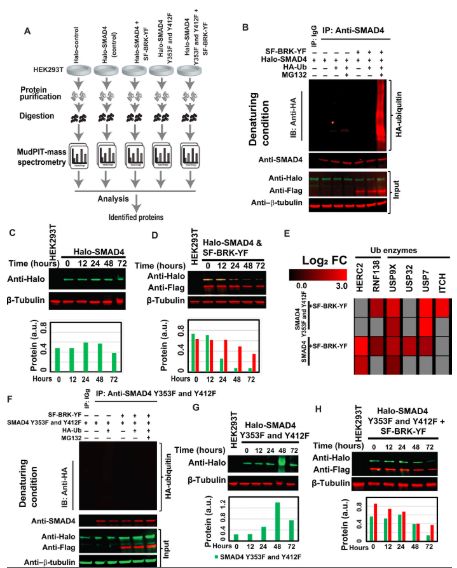
活化的BRK和SMAD4相互作用
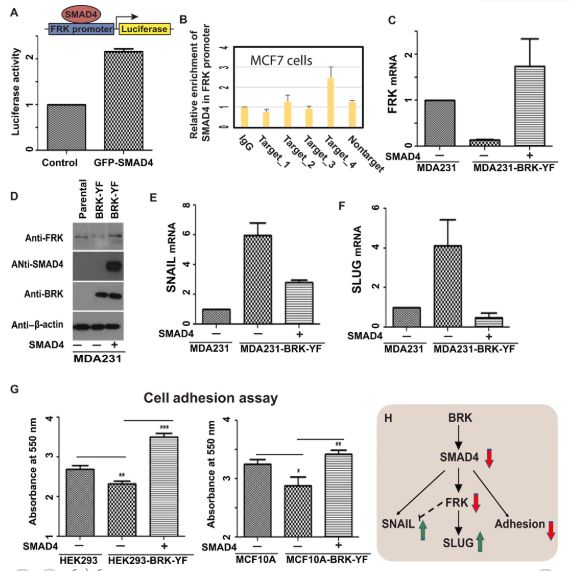
活化的BRK通过限制SMAD4的表达使FRK的表达下调
研究人员发现BRK和SMAD4在乳腺癌细胞中反向表达。活化的BRK可通过与SMAD4相互作用来调节TGF-β/ SMAD信号传导。BRK可使SMAD4发生磷酸化,而磷酸化的SMAD4则会进入遍在蛋白-蛋白酶体途径被降解。他们指出,活化的BRK还可通过限制SMAD4的表达使肿瘤抑制因子Fyn相关激酶(FRK)的表达下调,进而减少SMAD4与细胞粘附分子的相互作用,上调EMT标记SNAIL和SLUG,最终诱导EMT的发生,而EMT正是乳腺癌转移的前奏。也就是说,BRK的活化正是SMAD4表达受限的元凶,也是其一手导演了乳腺癌的转移。
这项研究提出了乳腺癌治疗的一种潜在新靶点,表明靶向活化BRK信号传导和促进SMAD4表达的联合疗法可能对SMAD4抑制的乳腺癌有益,这就为乳腺癌治疗提供了一条新思路,也为患者提供了新希望。当然目前只是理论时期,相信真正应用是会是诸多患者的福音。
参考文献:
S. Miah,et al.BRK phosphorylates SMAD4 for proteasomal degradation and inhibits tumor suppressor FRK to control SNAIL, SLUG, and metastatic potential.Science Advances 23 Oct 2019.
推荐阅读:
-
日程公布 | 第三届现代临床分子诊断论坛&第四届精准医学高峰论坛重磅来袭!
-
强强联手!新组合用药有望“创造”靶点,实现对癌症“围追堵截”
-
这些被忽视的免疫细胞,竟是乳腺癌细胞治疗的“潜力股”!
-
Science子刊:深挖“双面蛋白”沦为肿瘤免疫逃逸帮凶的真相
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发