边切边补,告别DNA双链完全断裂!新“魔剪”剑指89%遗传变异!
| 导读 | 基因治疗是最具革命性的医疗技术之一,它是以改变人遗传物质为基础的生物医学治疗手段。其中以CRISPR/Cas9为代表的基因编辑日新月异的发展极大地推动了基因功能研究进程。但是,“基因魔剪”的应用之路并非一帆风顺,技术本身存在的局限性极大地限制了其发展。 |
导 读:基因治疗是最具革命性的医疗技术之一,它是以改变人遗传物质为基础的生物医学治疗手段。其中以CRISPR/Cas9为代表的基因编辑日新月异的发展极大地推动了基因功能研究进程。但是,“基因魔剪”的应用之路并非一帆风顺,技术本身存在的局限性极大地限制了其发展。
近日,单碱基编辑技术开创者、Broad研究所David Liu教授研究团队在顶级学术期刊Nature发表了最新的基因编辑研究成果,报道了一种被称为“prime editing”的新型基因编辑技术。该研究革新了CRISPR/Cas9技术,成功在避免DNA双链断裂的基础上增加了可执行基因组编辑的类型,减少了基因插入失控和脱靶效应,提高了精准修正率,有望修正约89%的疾病相关人类遗传变异体!

CRISPR/Cas9——“基因魔剪”“魔力”受限
CRISPR/Cas9技术是一种RNA引导的基因组编辑技术,理论上能对基因进行精确敲除、敲入、替换等,从而探究基因功能、修复致病基因,为构建更高效的基因编辑技术提供了可能。但是,大量实验结果却指出CRISPR/Cas9对大多数突变的精准修正效率不高,插入缺失副产物导致的基因紊乱引发了群众对CRISPR/Cas9的犹豫。那么,“基因魔剪”“魔力”为何受限呢?
我们知道,CRISPR/Cas9进入细胞后,CRISPR序列可转录出 pre-crRNA和tracrRNA,而pre-crRNA、tracrRNA以及Cas9编码的蛋白将会组装成一个复合体。gRNA可通过碱基互补配对靶向目标序列,识别出与crRNA互补的前间隔序列,DNA双链将被解开。crRNA将与互补链杂交,而另一条链则保持游离状态。随后Cas9蛋白剪切crRNA互补的DNA链和非互补的DNA链,最终形成双链断裂(DSB),而生物体自身存在的DNA损伤修复应答机制可将断裂的上下游两端的序列连接起来,从而实现了细胞中目标基因的敲除。
换言之,CRISPR/Cas9编辑的核心步骤是双链DNA的断裂,这种断裂的主要修复方式是非同源末端连接,这是一种错误率极高的修复方式,容易发生移码插入或缺失,进而引发基因功能丧失,这就严重限制了CRISPR/Cas9的精准修正率,所以,想要打破这种局限性,就要避免双链DNA的断裂。
既然不想DNA双链一起断裂,那就只能分开修正,也就是说要对突变的位置进行“定点”修正。如何实现呢?研究人员将Cas9蛋白与逆转录酶,以及一种特殊的gRNA——pegRNA合成一个复合体。pegRNA不仅可以搜索特定的DNA位点,还能在Cas9-逆转录酶融合蛋白切割一条DNA链后直接用预编辑的遗传信息替换靶DNA序列,随后另一种可精确修复的DNA修复方式——同源修复启动,将新的遗传信息接入DNA序列。而另一条DNA链只要将这些步骤再实施一次就可正确编辑。这就实现了“边切边补”,彻底杜绝了DNA双链同时断裂引发的错配危机。
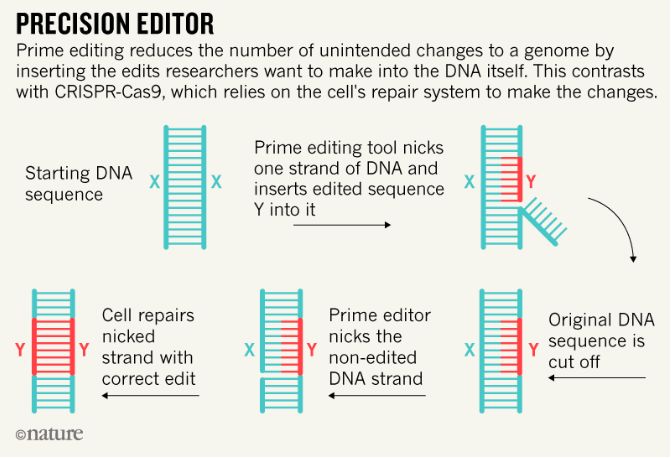
研究人员指出,prime editing技术能进行12种单碱基的转化,其最多可以插入44个碱基或删除80个碱基。他们在人体细胞执行了超过175次的编辑,确定这项技术比传统CRISPR/Cas9基因修正的精确率更高,效果更好,而且减少了副产物,更降低了脱靶率!
这项研究指出了一种新颖的基因编辑方案,克服了传统CRISPR/Cas9的盲点,这就意味着prime editing技术有望成为未来基因编辑领域更为绚烂的明星。当然这需要更多的时间和实验对其效果加以证明,我们静候佳音!
参考文献:
Andrew V. Anzalone,et al.Search-and-replace genome editing without double-strand breaks or donor DNA.Nature (2019) .
(转化医学网360zhyx.com)
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发