肺癌转移猝不及防?中国科学家奉上首个生化标志物!
| 导读 | 近日,中国科学院的研究人员首次揭示了肺癌转移的分子机制,他们发现糖醛酸代谢通路中的尿苷二磷酸葡萄糖(UDP-Glc)是肺癌转移的重要分子,其有望成为肺癌转移检测和治疗的生化靶点! |

众所周知,肺癌是发病率、死亡率增长最快,对人群健康和生命威胁最大的恶性肿瘤之一。传统手术以及术后放化疗对原发肿瘤的控制效果可观,然而面对其极高的转移率,诸多疗法都心有余而力不足,多数患者往往无法避免死亡的结局。因此,遏制肺癌转移是降低其死亡率的首要任务。想要有的放矢,需先明了肺癌转移的始末。近日,中国科学院的研究人员首次揭示了肺癌转移的分子机制,他们发现糖醛酸代谢通路中的尿苷二磷酸葡萄糖(UDP-Glc)是肺癌转移的重要分子,其有望成为肺癌转移检测和治疗的生化靶点!
肺癌转移——糖醛酸代谢通路“功不可没”
肺癌转移是治疗失败和病人死亡的主要原因。肺癌晚期可出现各个不同脏器的转移,可引起相应的症状,常给病人带来极大的痛苦甚至死亡威胁。肺癌为什么会转移?
我们知道,恶性肿瘤往往伴随着代谢异常。日益精进的基因检测技术告诉我们,癌症多为基因病。癌症相关基因突变可引起细胞内多种信号通路的改变,进而影响肿瘤细胞的代谢,并实现肿瘤细胞的重塑,使其存活和生长能力大大增强,并赋予细胞极强的“侵袭”能力。这份能力,正是肺癌转移的关键。那么,肺癌细胞的“侵袭”能力从何而来呢?
研究人员发现,敲除尿苷二磷酸葡萄糖脱氢酶(UGDH)可显著抑制肺癌细胞的转移,而UGDH是糖醛酸途径的限速酶,可催化UDP-Glc生成尿苷二磷酸葡萄糖醛酸(UDP-GlcUA)。这就意味着抑制糖醛酸途径就可以抑制肺癌细胞的转移,也就是说,糖醛酸途径应该就是赋予肺癌细胞侵袭能力的关键通路,其在肺癌转移过程中应该“功不可没”。
UDP-Glc——潜在的转移抑制分子与生物标志物
按理说,糖醛酸途径只是糖酵解的分支通路,为何会成为肺癌转移的关键通路呢?研究人员指出,这是因为该通路“搅和”进了肺癌细胞由突变基因控制的代谢异常。
他们发现,表皮生长因子受体(EGFR)激活后,UGDH的第473位酪氨酸(Y473)就会发生磷酸化。磷酸化的UGDH除了可将UDP-Glc转化为UDP-GlcUA,还多了一个功能——与mRNA稳定蛋白HuR结合,促进HuR的功能。
HuR蛋白的主要功能是与mRNA的3’端结合,进而增强mRNA的稳定性。正常情况下,保障mRNA的稳定性自然是件好事,可是,对于恶性肿瘤来说,就变成恶事了。
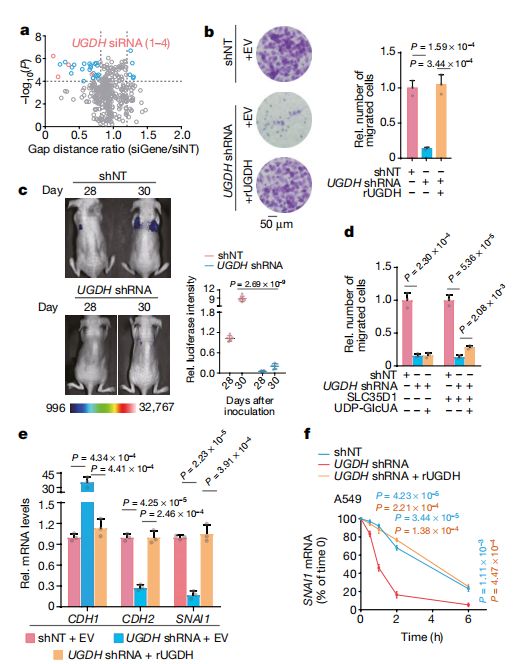
UGDH通过稳定SNAI1 mRNA的表达促进肿瘤细胞迁移
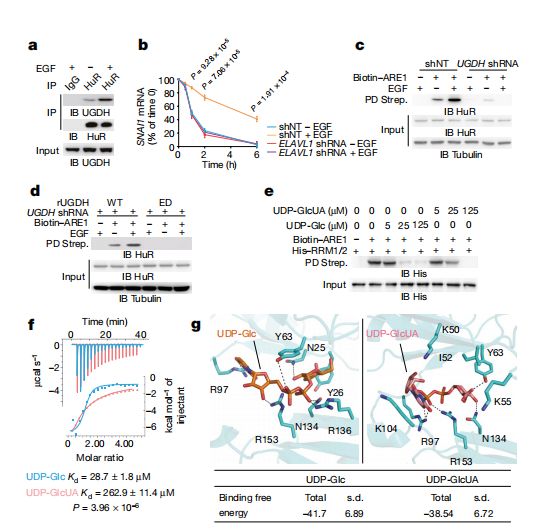
UGDH增强HuR与SNAI1 mRNA的结合并将UDP-Glc转换为UDP-GlcUA
这里就必须提一下肿瘤细胞获得转移能力的决定性步骤——上皮间质转化(EMT),该过程可赋予细胞转移和入侵的能力,是肿瘤转移的关键,而恶性肿瘤中SNAIL基因的表达是激活EMT的重要过程。所以,对肺癌细胞来说,SNAIL mRNA越稳定,其转移能力就越强。
研究人员发现,在原发性肺癌细胞中,UDP-Glc可明显抑制HuR与SNAI1 mRNA的结合,进而导致SNAI1 mRNA衰变!而一旦EGFR激活UGDH发生磷酸化,UDP-Glc就被极大消耗,丧失了对HuR与SNAI1 mRNA结合的抑制作用,从而增强了SNAI1 mRNA稳定性及蛋白表达!最终增强了肿瘤细胞迁移能力,促进了肺癌转移!换言之,提高UDP-Glc水平或是遏制肺癌转移的有效手段!
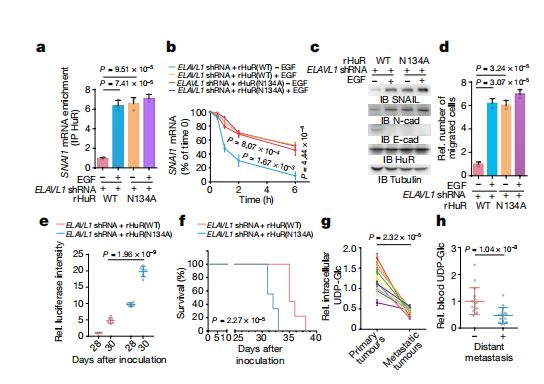
UDP-Glc明显抑制HuR与SNAI1 mRNA的结合
进一步的研究发现,UDP-Glc的水平与肺癌患者的转移密切相关!他们指出,转移灶中的UDP-Glc水平相较于原发灶明显降低!而且远端转移的UDP-Glc水平显著低于近端转移!这就意味着UDP-Glc水平有望作为肺癌转移情况的重要判断标准!
这项研究详尽地描述了肺癌转移的分子机制,发现了肺癌转移的重要分子,也提供了治疗与预测的新方向,是广大肺癌患者的福音。
(转化医学网360zhyx.com)
参考文献:
XiongjunWang,etal.UDP-glucose accelerates SNAI1 mRNA decay and impairs lung cancer metastasis.Nature (2019) .
关于癌症的更多研究进展,欢迎关注第二届上海国际癌症大会
第二届上海国际癌症大会将于10月11~13日召开。在大会上,研究者们将对免疫治疗、肿瘤微环境、代谢重编程、肿瘤标志物等主题进行热烈讨论,欢迎大家一起来聆听、分享自己的研究进展和见解~
(识别二维码进入报名入口,6月30日前半价哦)

 腾讯登录
腾讯登录










还没有人评论,赶快抢个沙发