CAR-T疗法最新重磅突破!体外T细胞扩增时间有望缩短10倍!
| 导读 | CAR-T疗法在2017年获得了无数的赞誉,被人们称为最有希望攻克癌症的疗法之一。然而CAR-T技术依旧存在着很多受限的地方,体外CAR-T细胞的扩增就是一难点。而在最新发布的《Nature》上面,这一困难有望被克服! |
CAR-T疗法作为新兴治疗方法获得无数专家认可和青睐。然而受限于诸多技术,CAR-T疗法依旧有着诸多不足。
在CAR-T治疗过程中,有一个步骤是将患者体内的T细胞在体外进行扩增,达到符合治疗要求的细胞数量,然而这个过程受限于技术,其时间占比很长。然而这个问题,有望得到解决!

CAR-T疗法全过程
发表在最新的《Nature Biotechnology》上面的一篇名为“Scaffolds that mimic antigen-presenting cells enable ex vivo expansion of primary T cells. ”文章就为我们揭开了一条崭新的道路:通过新的体外模仿抗原提成细胞的系统,可以使CAR-T细胞扩增速度大大提升!是原有速度的10倍!

在此篇文章中描述了一个模仿天然抗原提呈细胞(APCs)的系统,该系统由介孔二氧化硅微棒支持流体脂质双层组成。
脂质双分子层提供了T细胞受体刺激和共刺激的膜结合信号,而微棒能够缓释可溶性旁分泌信号。使用抗CD3,抗CD28和白细胞介素-2,该研究显示APC模拟支架(APC-ms)与商业扩增逐(Dynabeads)相比,促进了原代小鼠和人T细胞的多至10倍的多克隆扩增!
扩展的效率取决于刺激信号的密度和起始培养物中的物质的含量。单次刺激后,APC-ms使得稀有细胞毒性T细胞亚群的抗原特异性扩增比2周后的自体单核细胞来源的树突细胞大得多。 APC-MS支持比Dynabeads多5倍的再刺激的CD19 CAR-T细胞的扩增,在异种移植淋巴瘤模型中具有相似的功效。
基于T细胞的疗法是治疗各种疾病未来发展的方法之一,并且已经显示出在治疗B细胞急性淋巴细胞白血病和非霍奇金淋巴瘤中前所未有的临床成功案例。 然而,功能性T细胞的快速体外扩增仍然是一个挑战,T细胞是过继性细胞转移(ACT)的关键步骤。 T细胞激活需要三个信号:(1)T细胞受体(TCR)刺激,(2)共刺激,(3)促生存细胞因子。 在体内,这些信号由抗原呈递细胞(APC)提供,其以特定的时空模式将这些提示呈现给T细胞。
目前已经开发出各种方法用于扩大ACT的体外T细胞。其中,合成人工APC(aAPC)对于多克隆T细胞扩增特别方便。目前,用CD3(αCD3; TCR刺激)和CD28(αCD28;共刺激信号)的活化抗体功能化的商业微株(Dynabeads)代表了最常用的和临床相关的合成系统之一。这些株促进多克隆T细胞激活与外源性白细胞介素-2(IL-2)补充。尽管这些培养物为T细胞提供了三种关键信号,但是这些信号的呈现背景并不代表它们如何被APC自然呈递。这可能导致T细胞扩张速度不理想,功能受限或功能失调的T细胞产物。
另外,这些株是不可降解的,并且在输注之前必须与细胞产物分离,这增加了成本和制造上的困难,而且它们不适合于提供更大的共刺激信号,而这对于产生高功能治疗性T细胞可能是重要的。自体单核细胞来源的树突状细胞(moDCs)代表另一种用于原初和记忆T细胞的抗原特异性扩增的共同系统。虽然扩大的T细胞产品在癌症中已经显示出临床成功,但是由于长时间的细胞生产程序,供体moDC中的高度可变性以及常规再刺激的需要,使得moDCs的使用受到限制。
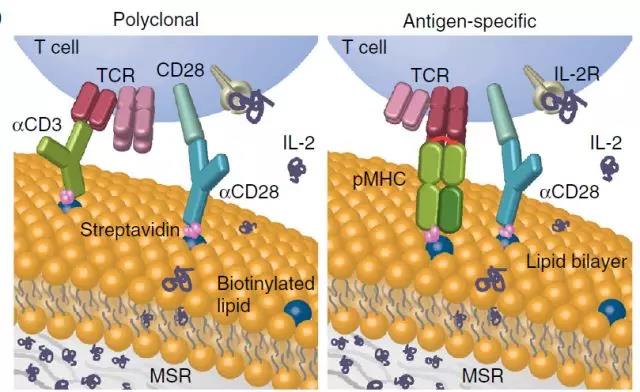
对于多克隆T细胞扩增,附着激活针对CD3(αCD3)和CD28(αCD28)的抗体(左)。 对于抗原特异性T细胞扩增,附着有肽的MHC(pMHC)和αCD28(右)。 在这两个,IL-2随着时间推移释放,导致旁分泌递送至局部T细胞
而在本次文章中,描述了在高比表面介孔二氧化硅微棒(MSR)上形成的由支持的脂质双层(SLB)组成的复合材料的发展。
SLB能够在流体脂质双层上以预定密度呈现T细胞活化线索的组合。已经使用功能化的SLB来研究T细胞活化和信号传导,并且已经将MSR用于药物递送和疫苗接种。
MSR-SLBs促进了可溶性信号向邻近T细胞的持续旁分泌释放,并且在官能化之后,使得表面和可溶性信号在T细胞中呈现类似于天然APC的情况。在细胞培养中,三维支架,这些由T细胞活化线索功能化的MSR-SLBs构成的支架被称为APC模拟支架(APC-ms).APC-ms促进了原代小鼠和人T的更多的多克隆和抗原特异性扩增细胞和CD19 CAR-T细胞,并且代表了一种灵活和可调谐的平台技术,可以使ACT的高功能T细胞迅速扩张。
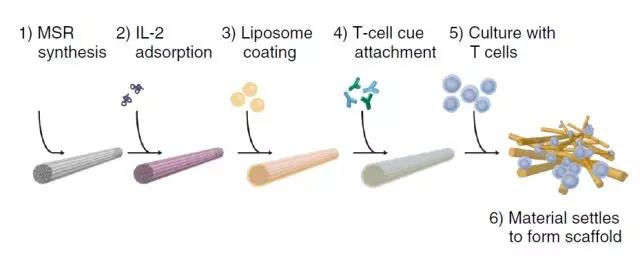
从MSRs制备APC-ms的过程
研究人员展示了一种多功能材料,以模仿自然条件下机体向T细胞呈现表面和可溶性提示。高纵横比的颗粒被用来形成APC-ms,这与大多数先前描述的合成aAPC材料形成对比。这些颗粒自发形成高表面积的三维支架,浸润T细胞重塑形成致密的细胞材料簇,创造一个微环境,其中T细胞位于靠近材料。
由于更多的T细胞可能与每个单独的杆相互作用(长约70μm,直径约4.5μm),杆的相对较大的尺寸和较高的纵横比可能有助于形成在APC-ms与Dynabead培养物中观察到的较大的簇)比较小的球形Dynabeads(4.5μm直径)。这些集群在APC-ms中的持久性取决于表面提示密度和文化中的材料数量,这可能有助于不同的在各种APC-ms条件下观察到的表型。
在本研究中,研究人员显示将IL-2加载到APC-ms中优于将相同量的IL-2作为可溶性团块添加到培养基中。 这与以前的工作是一致的,这表明以旁分泌的方式将细胞因子如IL-2递送至T细胞增强了细胞因子的效应。
当前合成的aAPC系统强调通过静态,高密度的TCR聚集和随后的T细胞活化刺激。该研究表明通过呈现T细胞刺激整个流体脂质双层表面,模拟这些提示如何在APC质膜呈现,相对较低的表面提示密度可以促进更多快速扩张速度并产生具有更多功能和更少耗尽表型的T细胞。 TCR的聚集仅仅是动态过程中的一个步骤,并且不仅用于增强T细胞激活,而且还用于限制TCR信号的持续时间以防止T细胞过度刺激。
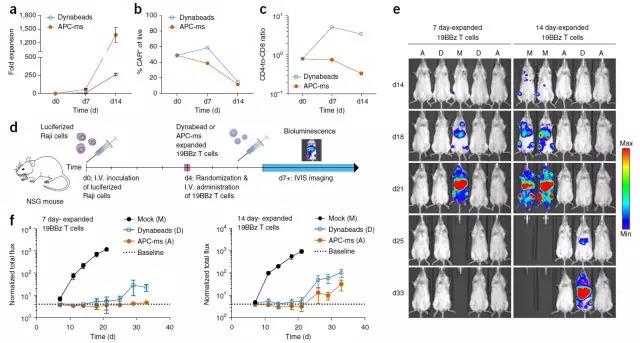
重新刺激的19BBz CAR-T细胞在播散性淋巴瘤异种移植模型中的体内功效
在多克隆小鼠T细胞扩增研究中,APC-ms促进了显着的CD8偏倚倾斜,其程度取决于特定的APC-ms制剂。这与先前观察到的IL-2旁分泌递送增强增殖一致的小鼠CD8 + T细胞,但在小鼠CD4 + T细胞中促进活化诱导的细胞死亡。相比之下,呈现更高量的T细胞刺激的制剂促进了多克隆人T细胞扩增中大量的CD4偏差倾向,而较低量的T细胞刺激促进了更均衡的CD4:CD8比率。与此观察一致,用APC-ms扩增的人CD19 CAR-T细胞(19BBz T细胞)保留了更平衡的CD4-CD8比率,与起始群体相似,而与Dynabeads扩增的19BBz T细胞经历了大量的CD4- 偏差倾斜。在小鼠和人类T细胞之间观察到的CD8与CD4偏差的差异可能表明小鼠和人类生物学的根本差异。对这更好的理解可以使材料制剂将混合的T细胞种群偏向特定的CD4与CD8的比例,最近证明该性质对于过继转移的T细胞的功能是十分重要的。
罕见的抗原特异性T细胞群的扩大是各种疾病治疗中的关键但是具有挑战性的步骤。尽管自体moDCs代表了扩大抗原特异性T细胞的金标准,但是需要以供体特异性的方式分离和培养moDCs增加了制造T细胞产品所需的资源和成本。捐助者与捐助者的高度差异也使得对生产过程进行标准化具有挑战性,甚至相同的T细胞亚群的初始频率和相对容易扩大也可能大不相同。在单次刺激后,APC-ms在培养1周后促进与moDCs相似的稀有T细胞亚群的抗原特异性扩增,但是在培养的第二周,在moDC培养物中观察到下降,观察到显著增加在同一时期在APC-MS文化。虽然这一观察结果的确切原因尚不清楚,但与APC-ms抗原呈递持续性的差异有关,与仅瞬时存在外源的活性moDC相比,抗原呈递的持续时间受其降解动力学控制装载的短肽。使用moCs的方案通常涉及多重再刺激以促进实质性富集罕见的T细胞亚群。
在个体化T细胞治疗中快速产生治疗相关数量的功能性T细胞是一个挑战,这项研究表明APC-ms为满足这一需求提供了一个进步。 APC-ms代表多功能材料平台,其比广泛使用的T细胞扩增系统(例如,Dynabeads和moDC)促进更有效的多克隆和抗原特异性细胞扩增。 APC-ms是一种模块化的平台技术,可以适应不同的线索,改变提示线索的空间和时间环境。例如,可以改变MSR性质来调整支架微环境或降解动力学。脂质制剂可以改变以调整SLB的稳定性,流动性或表面提示分区,或者通过不同的化学物质使线索附着。预计未来的APC-ms迭代可能会提供更多的表面和可溶性信号,从而为ACT产生进一步优化的T细胞。(转化医学网360zhyx.com)
参考资料:Alexander S Cheung, David K Y Zhang, Sandeep T Koshy, David J Mooney. Scaffolds that mimic antigen-presenting cells enable ex vivo expansion of primary T cells. http://dx.doi.org/10.1038/nbt.4047
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发