PNAS新报道!RSK2可促进细胞运动!
| 导读 | 定向迁移对细胞生长和癌细胞入侵等许多过程中的细胞运动至关重要。RSKs(p90核糖体S6激酶)是细胞迁移的核心调控分子,然而,介导RSK依赖性的细胞运动机制尚不明确。 |
细胞迁移是一个动态的过程,需要细胞根据细胞外刺激对细胞粘附和细胞结构进行定向和连续协调的适应调整。目前我们已明确了RSK2可以在促迁移刺激下促进细胞迁移和入侵。RSK2能直接结合RhoGEF LARG并将其磷酸化,从而促进LARG激活RhoA GTP酶。此外,还发现RSK2对表皮生长因子所诱导的Rho GTPases激活至关重要。这些结果提高了我们对细胞迁移,RSK激酶功能和LARG / RhoA激活的认识,揭示了该整合调控机制确切分子机制。

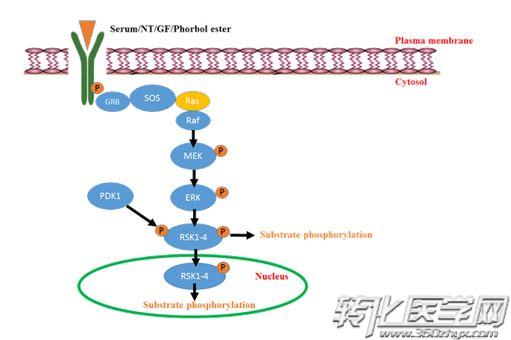
p90核糖体激酶(RSKs)参与多种癌症(包括肺癌,乳腺癌,黑素瘤和多形性胶质母细胞瘤(GBM))中的肿瘤细胞生长和转移。RSKs是由细胞外信号调节激酶(ERK)MAP激酶激活的丝氨酸/苏氨酸激酶,构成四种同工型(RSK1-4)。 RSKs是受体酪氨酸激酶(RTK)/ Ras / ERK信号传导的下游效应子。所有RSK同种型均含有两个激酶结构域:中央调控连接子结构域和羧基末端ERK对接位点。N-末端激酶结构域(NTKD)属于AGC激酶家族,负责所有已知底物的磷酸化。C-末端激酶结构域(CTKD)是CaM激酶家族的一部分并调节NTKD。RSK2的完全激活需要多个位点的磷酸化。
最初,ERK使Thr577处的CTKD和Ser369处的接头位点磷酸化。然后CTKD磷酸化Ser386,从而为PDK1生成一个停靠站点。PDK1结合并磷酸化NTKD中的Ser227,从而完全激活它。通过FGF受体3(在骨髓中)或Src和Fyn(在成纤维细胞中)磷酸化Tyr529进而增强不活泼的ERK与RSK的结合。整合素介导的粘附也会激活RSK2。因此,RSK有能力成为定向迁移的核心机制。RSKs通过丝氨酸A的磷酸化和转录的改变来影响整合素介导的细胞粘附的变化,最终协调迁移。 RSKs也显著影响细胞骨架动力学,但机制尚未完全了解。
Rho家族GTP酶是细胞骨架动力学的关键调控者并控制着许多细胞过程,包括细胞极性和迁移。虽然Rho家族GTP酶的体细胞突变在人类癌症中比较罕见,但异常的Rho信号传导有助于癌细胞增殖,侵袭和转移。重要的是,在GBM患者中发现了各种激活的Rho鸟嘌呤核苷酸交换因子(GEF)的突变。Rho GTPases的活性能在细胞迁移过程中很好地协调,但是对于Rho GTPases如何调控生长因子的理解仍然存在很大差距。
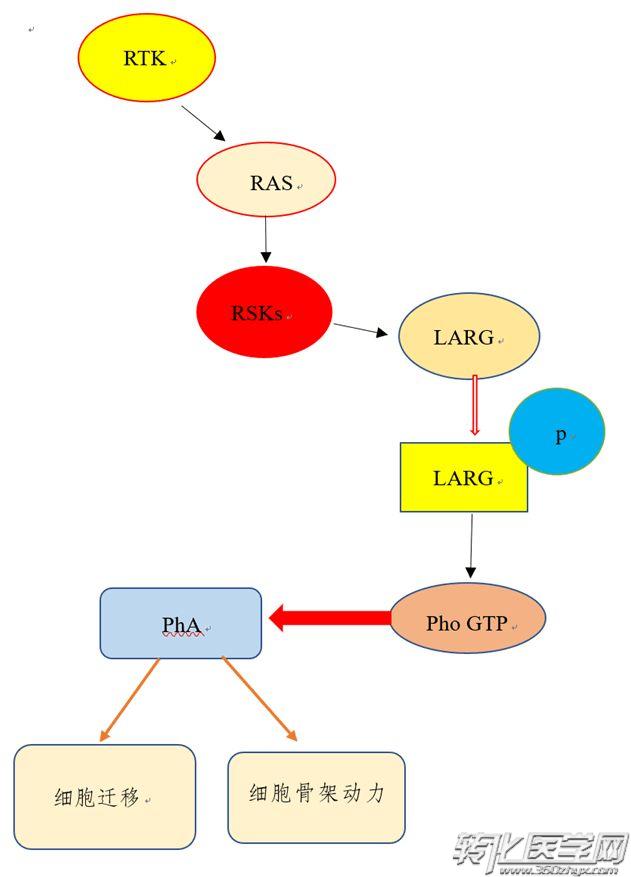
鉴于RSKs和Rho GTPases调节细胞迁移并影响GBM细胞骨架,我们检测了RSK2和Rho GTPases在迁移和侵袭GBM细胞系中的相互作用。并明确了特殊的RSK2信号通路,其中RSK2与LARG(ARHGEF12)和Rho GTPases形成复合物并直接磷酸化LARG,由此激活Rho GTPases并驱动定向的细胞迁移和侵入。
数据显示,在EGF或FBS刺激下RSK2能直接结合到RhoGEF LARG(ARHGEF12)并磷酸化其Ser1288的位点。然后LARG以RSK2依赖的方式结合并激活RhoA GTP酶。RSK2介导的LARG磷酸化和随后的RhoA GTPase活化促进了细胞迁移和侵袭。
我们进一步明确了RSK残基Thr577上的活性磷酸化突变,其诱导LARG和RhoA GTP酶激活以及随后的细胞迁移和侵袭。Thr577磷酸化是导致RSK2磷酸化和完全激活的起源。此外,在RhoA活化或细胞迁移中,S386E(PDK1对接所需)或S227E(对NTKD活化至关重要)都不具有与RSK2-T577E类似的活性。 Thr577E的磷酸化可能是帮助定义RSK2在人类疾病中病理生理学意义的重要工具。
RSK2不与无活性的无核苷酸结合的Rho异构体相互作用,而与活性核苷酸结合的Rho异构体直接相互作用。核苷酸加载到Rho GTPases时的构象变化似乎是这种直接相互作用所必需的。RSK2不具有功能性的GEF或GAP结构域。
因此,RSK2可能通过Rho特异性的RhoGEF LARG的磷酸化而激活RhoA GTP酶,其进而促进RhoA的GTP加载,从而形成RSK2-LARG-RhoA复合物形成所必需的构象。LARG属于含有G蛋白信号(RGS)结构域的RhoGEF家族的调节分子,并且是对Rac1或Cdc42无活性的RhoGEF,这与我们发现RSK2直接与Rho GTP酶相互作用相一致,而不是Rac1或Cdc42。 包括S369和S386的RSK2连接子结构域中的序列对于RSK2与RhoA GTP酶的结合似乎也是必需的。
异常的RSK2信号传导已经涉及发病机制,这包括Coffin-Lowry综合症和癌症在内的多种人类疾病。尽管RSK2体细胞突变在癌症中是罕见的,但是在多种癌症中过度活跃的RSK2信号传导是常见的。事实上,RSM2信号高的GBM患者预后差,生存率低,诊断后寿命缩短.RTK / Ras信号介导的Raf / MEK / ERK和PI3K / AKT的激活有助于GBM的侵袭.RSK2可以充当整合这两个信号级联的下游效应器。此外,RhoGEFs的过度活跃RhoGTPases可促进各种肿瘤的侵润。最近,旨在干扰LARG或RhoA相互作用的策略已显示出抑制肿瘤转化的作用。
我们的研究结果明确了RSK2在控制LARG-RhoA信号中的作用多种侵入性信号的特定作用。因此,针对这种独特的RSK2依赖性信号可能为具有异常RSK2信号的GBM患者有益处。抑制RSK信号在临床前模型中显示出有希望的效果。未来的研究是确定独立地靶向RSK或结合靶向LARG / Rho或化疗/放射疗法在GBM中的治疗价值。总之,我们的结果明确了一个未曾预料的调节癌细胞运动性的RSK2-LARG-RhoA信号转导通路并且这可能提供新的肿瘤治疗思路。
参考文献
Geng-Xian Shia, Won Seok Yanga, Ling Jina, Michelle L. Mattera, Joe W. Ramosa. RSK2 drives cell motility by serine phosphorylation of LARG and activation of Rho GTPases.PNAS. www.pnas.org/cgi/doi/10.1073/pnas.1708584115.
 腾讯登录
腾讯登录







还没有人评论,赶快抢个沙发