赵玉沛院士领衔!首次系统提出“代谢-表观遗传-免疫轴”概念,揭示了癌细胞通过动态整合代谢重编程、表观遗传修饰与免疫逃逸机制
| 导读 | 这一框架为突破当前肿瘤免疫治疗瓶颈提供了全新视角。 |
近日,中国医学科学院北京协和医学院赵玉沛/由磊/崔明团队在国际知名期刊《信号转导与靶向治疗》(Signal Transduction and Targeted Therapy,IF=52.7)发表了一项重磅综述:首次系统提出“代谢-表观遗传-免疫轴”概念,揭示了癌细胞通过动态整合代谢重编程、表观遗传修饰与免疫逃逸机制,实现持续进化与治疗抵抗的关键机制。这一框架为突破当前肿瘤免疫治疗瓶颈提供了全新视角。
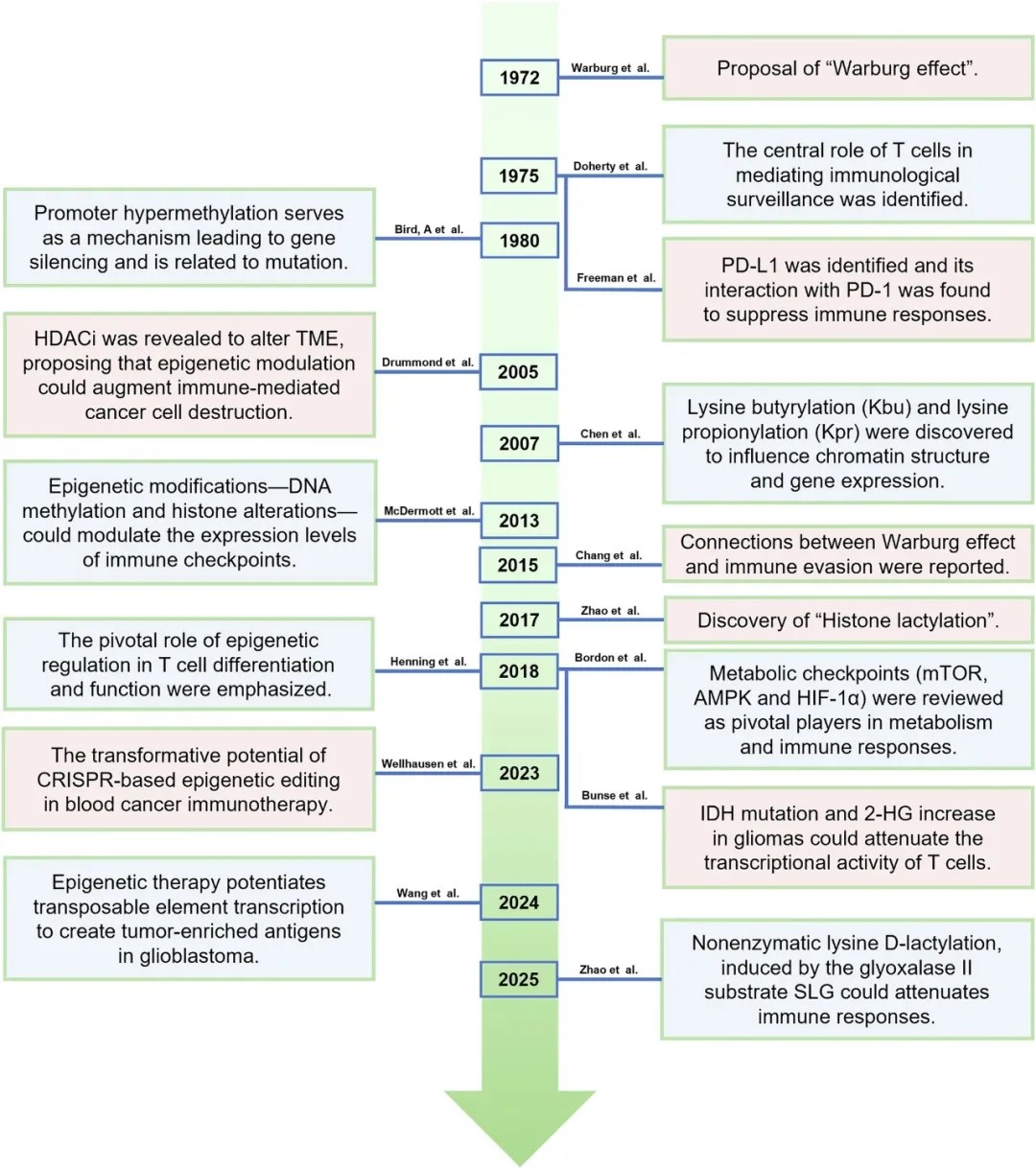
癌症代谢-表观遗传-免疫调控里程碑事件的回顾性总结
癌细胞的多维防御网络:从局部适应到系统失控
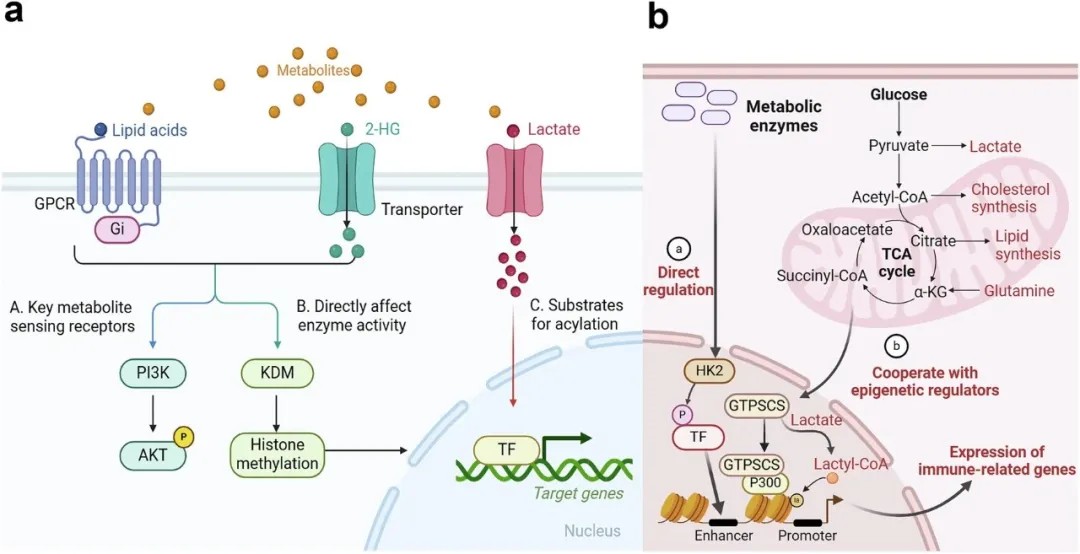
代谢与表观遗传整合的生物学基础
文章指出,癌细胞在肿瘤发生、转移及治疗抵抗过程中,通过代谢产物(如乳酸、琥珀酸等)直接调控表观遗传修饰(如组蛋白乳酰化、琥珀酰化),进而重塑免疫细胞功能。例如,肿瘤微环境中的乳酸不仅抑制T细胞活性,还可通过诱导组蛋白乳酰化促进PD-L1表达,加速免疫逃逸。此外,肿瘤细胞通过外泌体携带代谢酶或非编码RNA,远程调控远处器官的基质细胞,形成“预转移灶”,为转移奠定基础。
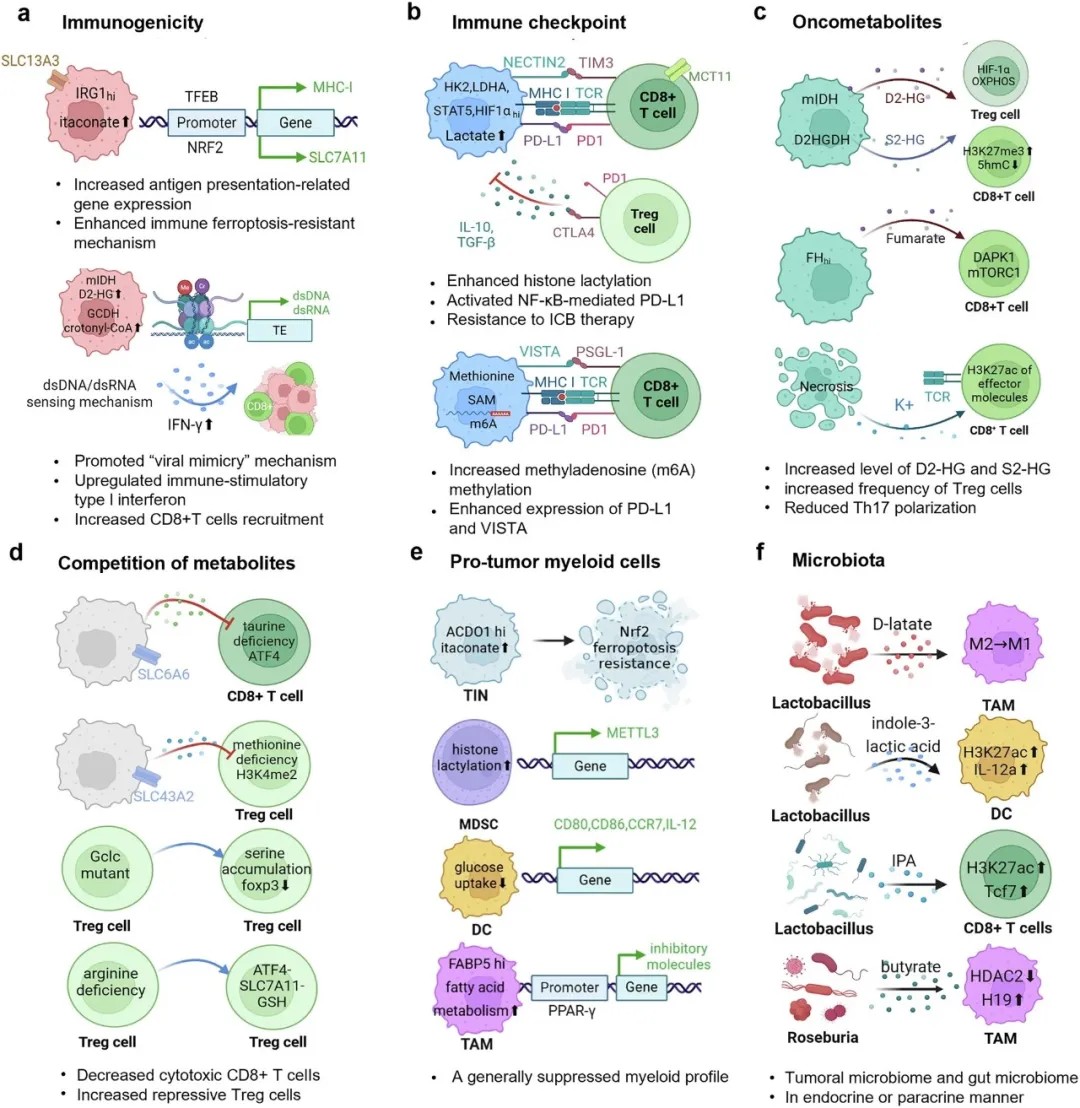
肿瘤微环境中的代谢-表观遗传-免疫策略
治疗新策略:靶向节点实现“多维破防”
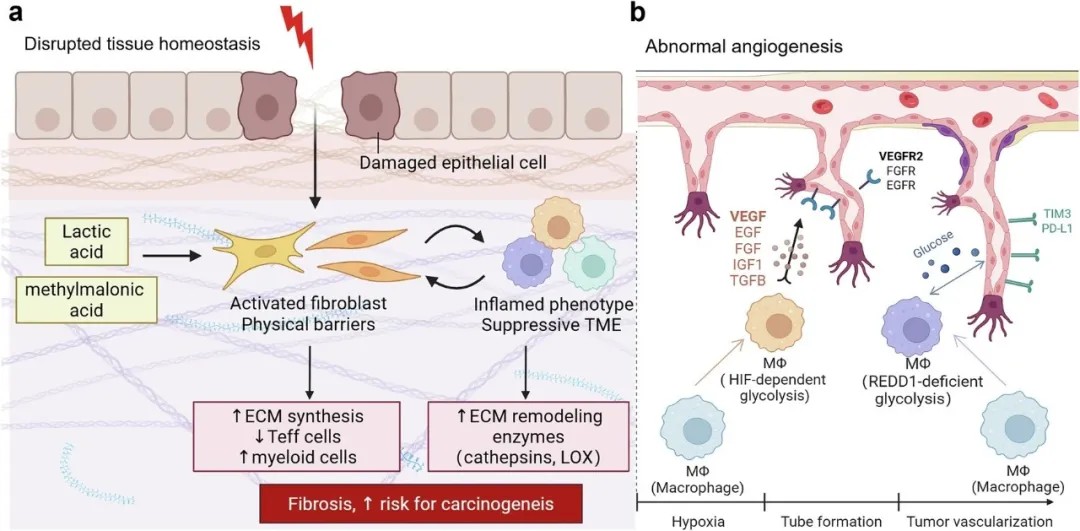
代谢-表观遗传-免疫轴在肿瘤发生中的作用
基于该轴心机制,研究提出联合靶向代谢与表观遗传关键节点的治疗策略。临床前研究表明:
-
代谢干预:抑制乳酸脱氢酶(LDHA)可增强抗PD-1疗效,而靶向谷氨酰胺代谢能同时抑制肿瘤能量供应并增强T细胞线粒体功能。
-
表观遗传调控:DNA甲基化抑制剂或组蛋白去乙酰化酶抑制剂可逆转T细胞耗竭,提升免疫检查点抑制剂敏感性。
-
微生物组协同:肠道菌群代谢产物通过调控T细胞表观遗传状态,增强免疫治疗效果。
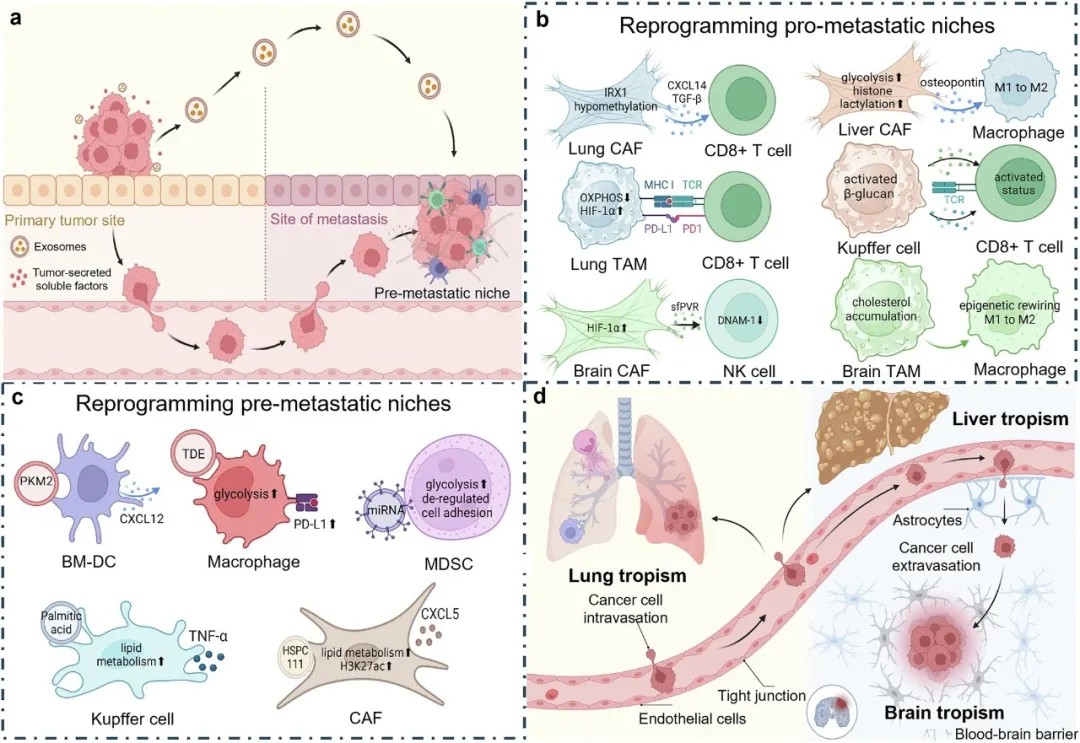
肿瘤细胞与靶器官间的双向选择与协同适应机制
新方向:AI与跨物种模型驱动精准疗法的进化
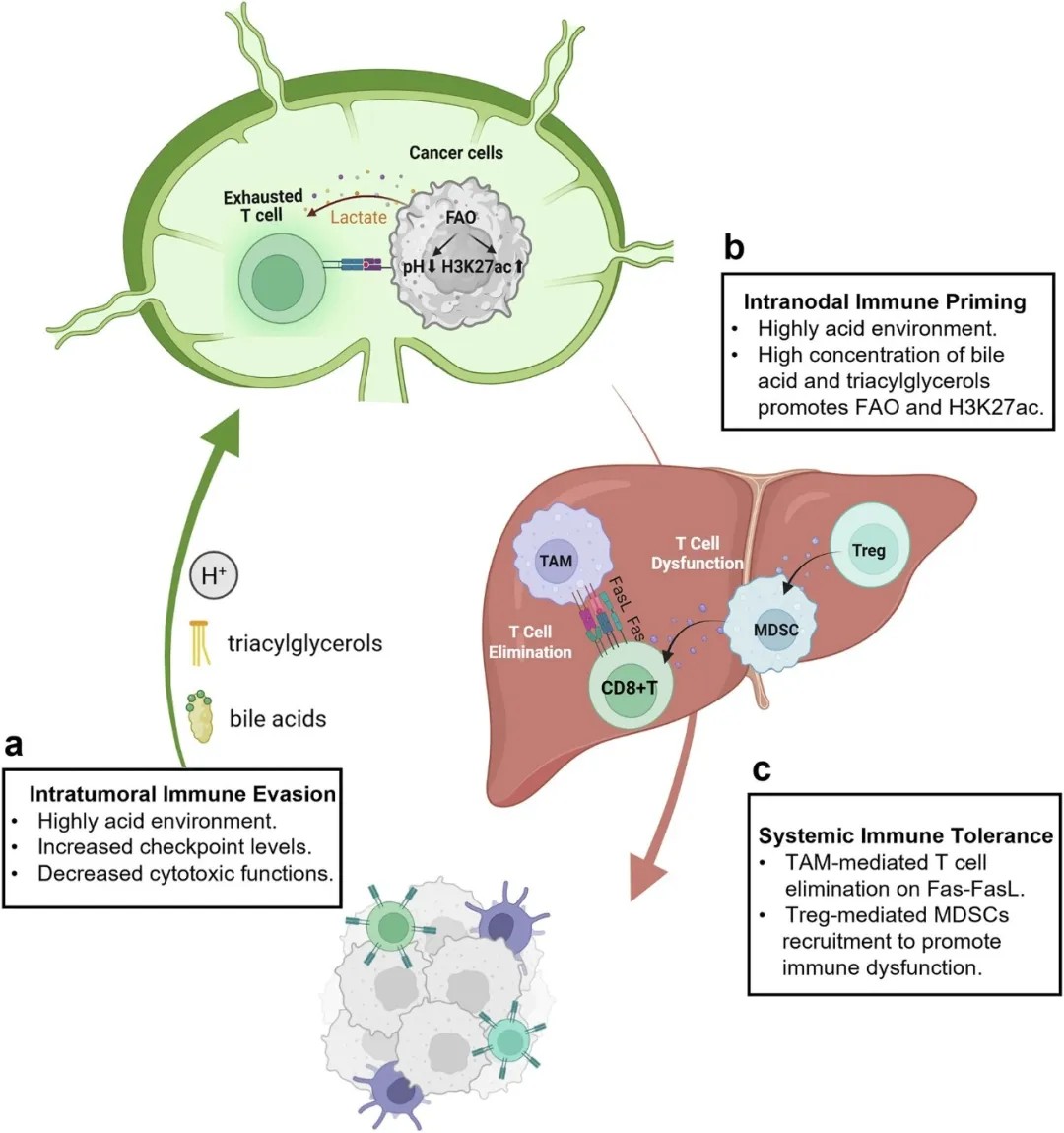
淋巴结与肝脏在肿瘤进展中系统性免疫耐受的作用
尽管联合疗法前景广阔,但仍面临肿瘤异质性、靶点选择性不足及物种差异等挑战。需通过单细胞多组学技术解析肿瘤亚克隆的代谢-表观遗传特征,并结合人工智能平台预测最佳干预时序。值得注意的是,该机制在进化上高度保守,为跨物种比较肿瘤提供了新思路。
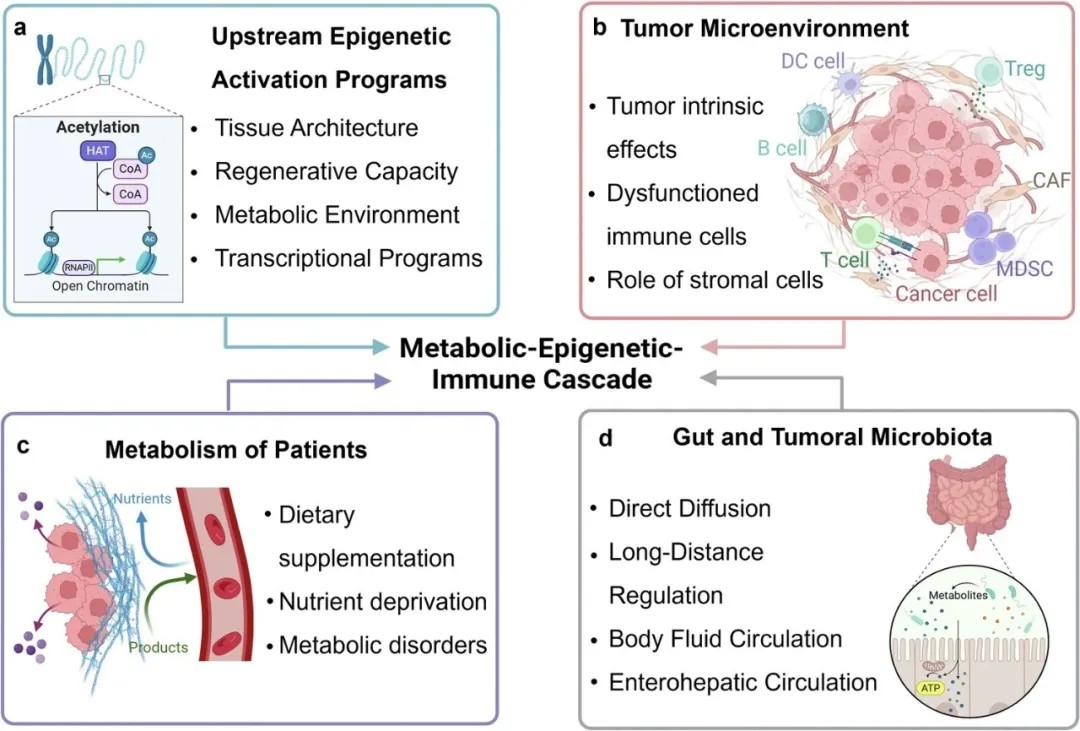
代谢-表观遗传-免疫轴的调控策略
未来展望:从“单点突破”到“系统重构”的肿瘤治疗新范式
“代谢-表观遗传-免疫轴”框架将癌症重新定义为一种动态演化的生态系统,其治疗策略需从静态靶向转向动态适配。未来,通过整合实时代谢成像、微生物组工程和AI指导的临床试验设计,有望实现“个体化多维疗法”,最终攻克肿瘤的进化韧性。
原文链接:
https://www.nature.com/articles/s41392-025-02334-4(转化医学网360zhyx.com)
【关于投稿】
转化医学网(360zhyx.com)是转化医学核心门户,旨在推动基础研究、临床诊疗和产业的发展,核心内容涵盖组学、检验、免疫、肿瘤、心血管、糖尿病等。如您有最新的研究内容发表,欢迎联系我们进行免费报道(公众号菜单栏-在线客服联系),我们的理念:内容创造价值,转化铸就未来!
转化医学网(360zhyx.com)发布的文章旨在介绍前沿医学研究进展,不能作为治疗方案使用;如需获得健康指导,请至正规医院就诊。
责任声明:本稿件如有错误之处,敬请联系转化医学网客服进行修改事宜!
微信号:zhuanhuayixue
 腾讯登录
腾讯登录









还没有人评论,赶快抢个沙发